Patología
¿Qué es la hiperplasia benigna de la próstata?
La hiperplasia benigna de la próstata (HBP) es el aumento de tamaño de la próstata que resulta de la proliferación del tejido glandular y del estroma1. El agrandamiento de la próstata es causa frecuente (aunque no la única) de obstrucción infravesical y de síntomas del tracto urinario inferior (STUI, lo que antiguamente se llamaba prostatismo)2,3.
El agrandamiento de la próstata se debe, en gran medida, a la acción local de la dihidrotestosterona, pero también contribuyen otros factores, como la inflamación (cuya causa no está clara)4.
El agrandamiento obstruye la salida de la orina, y esta obstrucción aumenta la presión vesical, lo cual provoca la remodelación de la estructura de la vejiga. Inicialmente, se produce hipertrofia del detrusor ―principal alteración morfológica de este proceso―, que contrarresta la resistencia uretral y permite que la función vesical permanezca relativamente normal. Sin embargo, aumenta la sensibilidad del detrusor, que responde incluso a pequeñas cantidades de orina en la vejiga; esto contribuye a síntomas irritativos, como la polaquiuria5. También aumenta gradualmente el tejido conectivo entre las fibras musculares y disminuye la elasticidad de la vejiga, por lo que se reduce la capacidad de llenado6,7.
¿Cuáles son los factores de riesgo de la hiperplasia benigna de la próstata?
Los principales factores que afectan al riesgo de padecer HBP son los siguientes:
- Edad. La HBP aumenta con la edad. La prevalencia histológica es del 8 % en la cuarta década de la vida, del 50 % en la sexta década y de 80 % en la novena década8.
- Raza. La prevalencia de la HBP es similar en la raza negra y blanca; sin embargo, aunque los datos varían según los estudios, en los hombres negros suele ser más grave4,5,8. Por su parte, los datos parecen indicar que la prevalencia es menor en los asiáticos4,8.
- Factores genéticos. Los estudios indican que tienen un papel importante en la HBP. El tamaño prostático es mayor y el diagnóstico es más temprano en la HBP hereditaria que en la esporádica4.
- Alimentación. Aunque los estudios no son concluyentes, parece que ciertos macronutrientes y micronutrientes influyan en el riesgo de HBP. Es posible que aumenten el riesgo el elevado consumo total de calorías, el exceso de proteínas, la carne roja, la grasa, los lácteos, los cereales y las aves de corral. Por el contrario, parecen reducir el riesgo las verduras, las frutas, los ácidos grasos poliinsaturados, el ácido linoleico, la vitamina D, las concentraciones elevadas de vitamina E, el licopeno, el selenio, el β-caroteno8 y la vitamina A4.
- Ejercicio físico. El ejercicio físico disminuye el riesgo de HBP y STUI, así como la necesidad de tratamiento quirúrgico8.
- Alcohol. El consumo moderado de alcohol no afecta a la HBP, pero es posible que el consumo excesivo (tres o más bebidas diarias) disminuya el riesgo, al reducir la cantidad de andrógenos4.
- Obesidad y síndrome metabólico. La adiposidad se correlaciona con el volumen de la próstata: a mayor adiposidad, mayor volumen8. Esto puede deberse a la conversión de los andrógenos en estrógenos en el tejido adiposo y a la hiperinsulinemia4. El riesgo de los pacientes obesos de padecer HBP es 3,5 veces mayor que el de los pacientes con normopeso8. Además, la próstata de los hombres con síndrome metabólico tiene mayor volumen y crece más rápido que la de los hombres sin síndrome metabólico4.
- Disfunción eréctil. La disfunción eréctil y la HBP están relacionadas, aunque no está claro cuál precede a cuál ni si la relación es causal8.
La edad, la susceptibilidad genética, la raza negra, la obesidad y el síndrome metabólico son factores de riesgo de padecer HBP, mientras que practicar ejercicio físico y beber alcohol de forma excesiva son factores protectores. La dieta también influye en la HBP4,8.
¿Cuál es el cuadro clínico de la hiperplasia benigna de la próstata?
Los STUI pueden dividirse en síntomas de llenado, de vaciado y posmiccionales (tabla 1). Las definiciones de cada síntoma se muestran en el cuadro 1.
Tabla 1. Clasificación de los síntomas del tracto urinario inferior
| Síntomas de llenado* | Síntomas de vaciado** | Síntomas posmiccionales |
|
|
|
* Irritativos
** Obstructivos
Fuente: Menéndez Fernández et al.1, Gravas et al. 2, McVary et al. 9
Los STUI se asocian a alteraciones del sueño y depresión, y limitan las actividades de la vida diaria9. Por lo general, los síntomas de llenado son más molestos que los de vaciado y los posmiccionales1,9.
Cuadro 1. Glosario de síntomas del tracto urinario inferior
Síntomas de llenado o almacenamiento: aparecen durante la fase de llenado y almacenamiento de la orina.
Síntomas de vaciado: aparecen en el momento de la emisión de la orina.
Síntomas posmiccionales. Ocurren después de orinar.
|
Fuente: Menéndez Fernández et al.1, McVary et al.9
La HBP no es la única causa de STUI; otras causas son las siguientes1,2,9:
- Estenosis uretral.
- Litiasis ureteral distal
- Tumor vesical
- Cuerpo extraño
- Cáncer de próstata
- Prostatitis
- Infección del tracto urinario.
- Poliuria nocturna.
- Vejiga hiperactiva / Hiperactividad del detrusor
- Disfunción neurógena vesical.
- Hipoactividad del músculo detrusor
- Síndrome de dolor pélvico crónico
Diagnóstico
¿Cómo se diagnostica la hiperplasia benigna de próstata?
La evaluación diagnóstica tiene como objetivo diferenciar el origen de los STUI y, una vez se establece que la causa es la HBP, determinar los síntomas predominantes, la intensidad y el riesgo de progresión, para así decidir el mejor tratamiento2,10.
Anamnesis
En la evaluación de todo hombre con STUI, se debe indagar sobre1,2,10:
- Antecedentes familiares de HBP y de cáncer de próstata.
- Antecedentes de traumatismos o intervenciones quirúrgicas uretrales.
- Enfermedades que pueden causar STUI: diabetes, insuficiencia cardíaca, enfermedades neurológicas (esclerosis múltiple, ictus, enfermedad de Parkinson).
- Fármacos que pueden afectar a la contractilidad vesical (por ejemplo, anticolinérgicos, como los antihistamínicos, las benzodiacepinas y algunos antidepresivos), aumentar la resistencia al flujo urinario (por ejemplo, simpaticomiméticos, como los broncodilatadores) o aumentar la frecuencia miccional (como los diuréticos).
- Disfunción eréctil: se recomienda el cuestionario de salud sexual para hombres (SHIM)11.
- Caracterización de los síntomas: inicio, duración, intensidad, afectación de la calidad de vida, etc.
En relación con la valoración de los síntomas, son muy útiles los cuestionarios validados y los diarios miccionales.
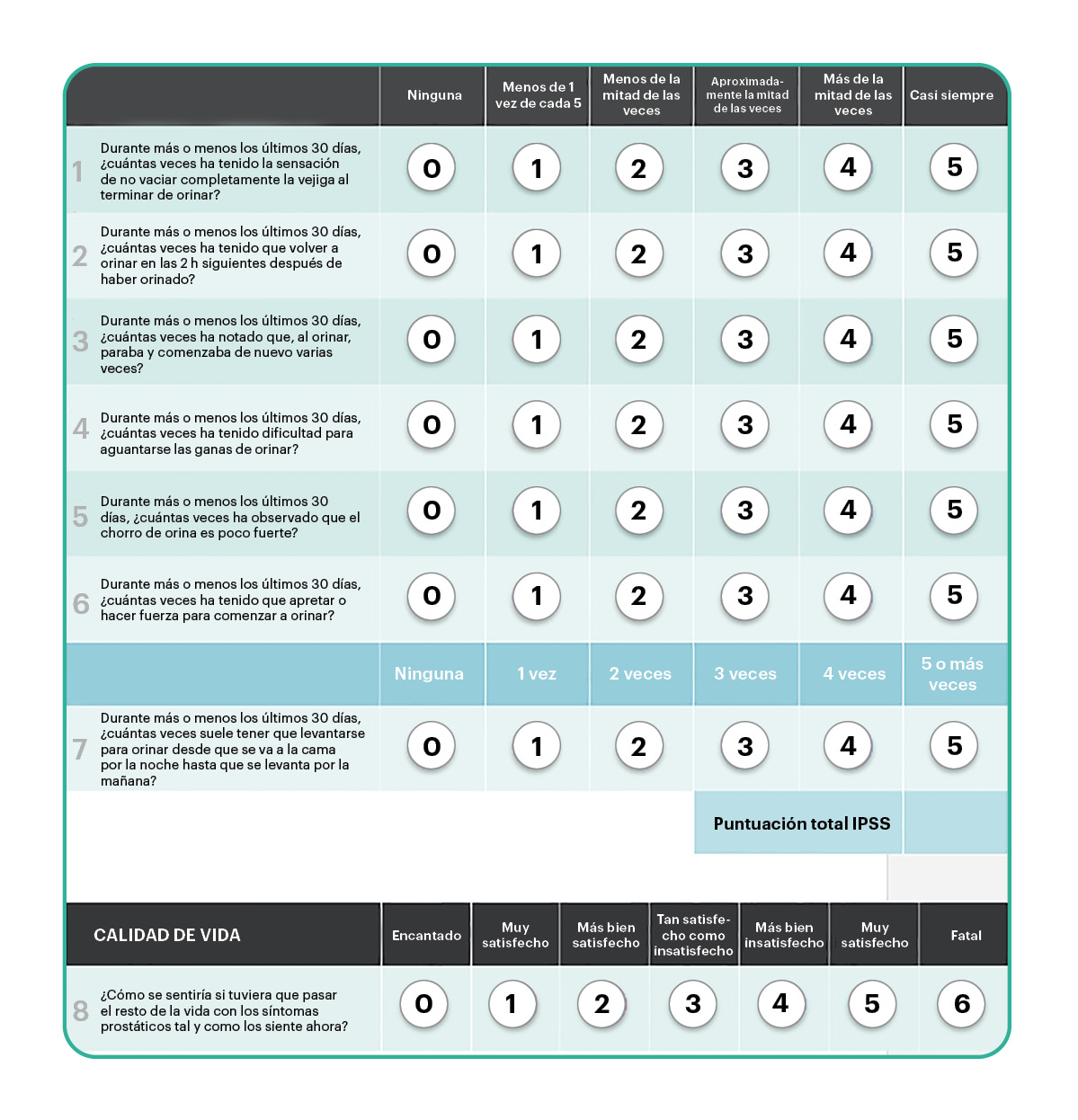
Escala internacional de síntomas prostáticos (IPSS, ‘international prostate symptom score’)
Es el cuestionario de valoración de síntomas que más se usa (figura 1).
Figura 1. Escala internacional de síntomas prostáticos (IPSS)
Fuente: Brotons Muntó12
El IPSS consta de 8 ítems: 7 preguntas sobre síntomas y 1 pregunta sobre calidad de vida2.
Las primeras 7 preguntas interrogan sobre la intensidad de los STUI durante los últimos 30 días. Cada una de ellas tiene una puntuación de 0 a 5 (de menor a mayor intensidad). Una vez completadas, se obtiene un rango de puntuación total de 0 a 35 puntos. Según el resultado obtenido, se clasifica la intensidad de los síntomas en:
- leve (0-7 puntos),
- moderada (8-19 puntos),
- grave (20-35 puntos).
Una variación de la puntuación de 4 o más puntos se considera clínicamente significativa11.
La octava pregunta evalúa el grado en que los síntomas afectan a la calidad de vida. Su puntuación es de 0 a 6 (de menor a mayor molestia). Las puntuaciones de 4 o más puntos se relacionan con una afectación importante de la calidad de vida12.
El IPSS sirve para valorar la necesidad de tratamiento farmacológico, evaluar la eficacia del tratamiento y hacer el seguimiento del paciente. Puede rellenarlo el paciente o el profesional sanitario y debe repetirse en las visitas sucesivas2,12.
Diario miccional
Es particularmente útil para los pacientes en quienes predomina la nicturia, pero puede serlo también para los demás. Los datos se recogen durante, al menos, 3 días, para tener una idea más precisa de la dinámica miccional. Se le pide al paciente que recoja la siguiente información2,10:
- ingesta de líquidos;
- volumen de orina total en 24 horas y por la noche (para calcular el índice de poliuria nocturna, es decir, la proporción de orina que se produce por la noche);
- frecuencia miccional de día y de noche;
- urgencia y episodios de incontinencia;
- uso de absorbentes.
Exploración física
Debe centrarse en el área suprapúbica, los genitales externos y el perineo, en busca de globo vesical, secreción uretral, estenosis del meato, fimosis, cáncer de pene u otras causas de obstrucción. Se explorará neurológicamente la pelvis y los miembros inferiores, y debe estudiarse cualquier alteración que se encuentre, dada la complejidad de las interacciones neurológicas implicadas en la regulación de la diuresis2,10.
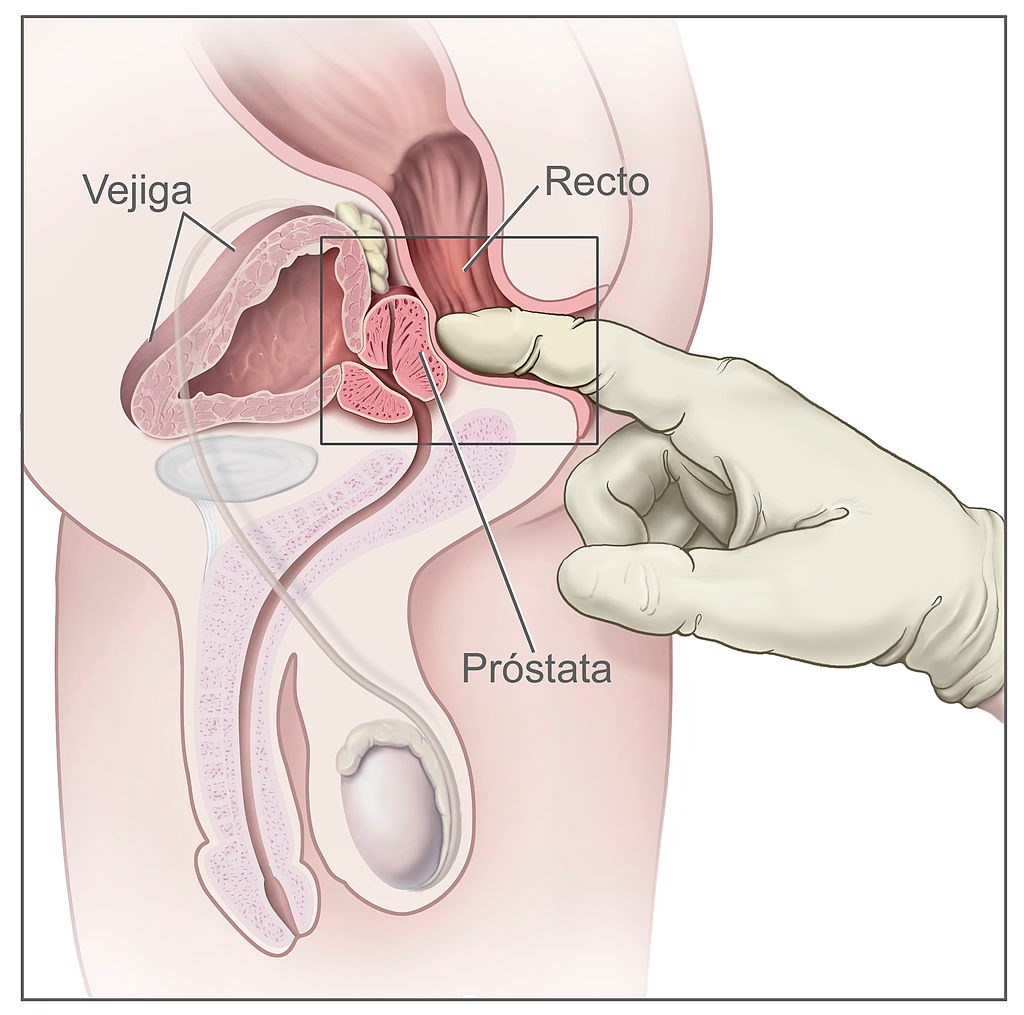
La exploración física debe incluir el tacto rectal, que es la manera más simple de evaluar el volumen de la próstata, aunque su correlación con el volumen real es escasa. El tacto rectal es menos preciso que la ecografía transrectal para estimar el tamaño de la próstata y tiende a subestimarlo, sobre todo con volúmenes grandes (>30 ml)2. Sin embargo, puede detectar otras alteraciones, y los tactos rectales seriados son útiles para vigilar la evolución del tamaño de la próstata2,10.
Los pasos para hacer un tacto rectal son los siguientes (figura 2)13:
- Pedir al paciente que se coloque en una de las siguientes posturas:
- De pie, con los codos encima de la camilla.
- Posición genupectoral, con rodillas y codos en la camilla.
- Decúbito lateral izquierdo, con las piernas flexionadas.
- Posición de litotomía.
- Lubricar el dedo índice, aplicar presión en la abertura anal y pedir al paciente que haga fuerza para relajar el esfínter externo.
- Introducir el dedo con lentitud hacia el recto.
- Girar por completo el dedo en ambos sentidos para explorar las paredes del recto en toda la circunferencia.
- Deslizar el dedo hacia abajo, a lo largo del surco medio, hasta llegar a un área blanda (la uretra membranosa) y palpar la superficie posterior de la glándula prostática.
Figura 2. Tacto rectal
La tabla 2 muestra cómo se interpreta el tacto rectal.
Tabla 2. Interpretación del tacto rectal
| ¿Qué se evalúa? | ¿Qué es lo normal? | ¿Qué se aprecia en la HBP? |
| Sensibilidad | Indolora | Indolora |
| Tamaño | 20 cm3 (como una nuez) | Aumentado |
| Superficie | Lisa y uniforme, sin nódulos
Surco medio |
Lisa y uniforme, sin nódulos
Puede borrarse el surco medio |
| Consistencia | Como la punta de la nariz | Como la eminencia tenar |
| Límites | Precisos y regulares | Precisos y regulares |
| Movilidad | Móvil | Móvil |
Fuente: Rubinstein et al.14
¿Qué pruebas complementarias se recomiendan en los pacientes con hiperplasia benigna de la próstata?
La única prueba complementaria que todas las guías clínicas consideran obligatoria en los pacientes con HBP es el análisis de orina. En cuanto al antígeno prostático específico (PSA), lo consideran recomendable, pero no obligatorio. La fuerza de recomendación del resto de las pruebas varía entre opcional y recomendada, según la guía2,11,15,16.
Análisis de orina (mediante sedimento urinario o tira reactiva)
Debe hacerse en todos los pacientes, para identificar otras posibles causas de los STUI, como infecciones del tracto urinario, microhematuria y diabetes mellitus. Aunque la microhematuria puede estar presente en la HBP, siempre obliga a ampliar el estudio para descartar otras causas. Solo se recomienda cultivo de orina si se sospecha infección, no de forma sistemática2,10.
Antígeno prostático específico (PSA)
Es un marcador del tejido prostático que se correlaciona con el tamaño de la próstata2. En el 30 %‑50 % de los hombres con HPB, los niveles séricos de PSA pueden estar moderadamente elevados, según el tamaño de la próstata y el grado de obstrucción17.
El PSA puede predecir el riesgo de progresión y complicaciones de la HBP, como la retención urinaria aguda y la necesidad de cirugía2. El riesgo de retención aguda de orina aumenta incluso hasta 8 veces con valores basales de PSA >1,4 ng/ml18.
¿Cuándo se recomienda determinar el PSA en la hiperplasia benigna de próstata?
En general, las asociaciones científicas no consideran obligatorio ―pero sí recomendable, sobre todo en ciertas situaciones― determinar el PSA en pacientes con HBP2,11,15,16.
No es necesario determinar el PSA para diagnosticar la HBP, pero se recomienda si contribuye a definir el tratamiento2,10.
Es importante determinarlo si se valora empezar con inhibidores de la reductasa 5α, ya que estos fármacos son útiles en hombres con próstatas >40 ml o PSA >1,4-1,6 ng/ml. Además, los inhibidores de la reductasa 5α disminuyen el PSA alrededor del 50 % después de 6 a 12 meses de tratamiento, lo cual puede afectar al cribado del cáncer de próstata2; por eso, es conveniente conocer el valor del PSA antes de comenzar el tratamiento con este tipo de fármacos10.
También se recomienda determinar el PSA si el diagnóstico de cáncer de próstata cambia el abordaje del paciente2.
¿Cuáles son las recomendaciones de cribado del cáncer de próstata?
El PSA es un parámetro continuo; cuanto mayor sea su valor, mayor es la probabilidad de cáncer de próstata. Sin embargo, un valor elevado de PSA no equivale a cáncer, ya que puede aumentar por otras causas (cuadro 1). Asimismo, no existe un punto de corte que elimine la posibilidad de tener cáncer de próstata; de hecho, hay pacientes con cáncer y PSA normal.
Cuadro 1. Factores que aumentan el PSA
| Hiperplasia benigna de próstata Prostatitis Retención urinaria Biopsia prostática Masaje prostático Infección del tracto urinario Tacto rectal Actividad sexual Ejercicio físico Cáncer de próstata |
Fuente: Ibarra et al.19
Las recomendaciones de uso del PSA junto con el tacto rectal como método de cribado del cáncer de próstata son controvertidas. El cribado aumenta el número de diagnósticos de cáncer y de diagnósticos de cáncer localizado frente a cáncer avanzado, pero el efecto sobre la supervivencia parece escaso y puede llevar al sobrediagnóstico y sobretratamiento20,21.
Por eso, las asociaciones científicas20-22 están de acuerdo en que siempre hay que asegurarse de que el paciente entiende los riesgos y beneficios del cribado, y se debe tomar la decisión según sus preferencias. Asimismo, no recomiendan el cribado en hombres con una esperanza de vida <10-15 años. Aparte de esto, las recomendaciones varían según los diferentes organismos científicos.
La Asociación Europea de Urología (EUA)20 aconseja:
- Ofrecer el análisis de PSA a los siguientes grupos de riesgo de cáncer de próstata:
- Hombres >50 años.
- Hombres >45 años con antecedentes familiares de cáncer prostático.
- Afroamericanos >45 años.
- Hombres >40 años con mutaciones del gen BRCA2.
- En general, el seguimiento se hace cada 2 años, excepto en hombres sin factores de riesgo en los que el PSA inicial es <1 ng/ml a los 40 años o <2 ng/ml a los 60 años, en lo que puede hacerse cada 8-10 años.
- Además, para ayudar a decidir si es preciso biopsiar, y de esta forma evitar biopsias innecesarias, la EUA recomienda ofrecer una evaluación más amplia del riesgo a hombres asintomáticos con tacto rectal normal y PSA entre 2 y 10 ng/ml. Para ello, puede usarse una calculadora del riesgo, una técnica de imagen (resonancia magnética nuclear, si está disponible) o, aunque el grado de certidumbre científica es menor, una prueba serológica (detección de calicreínas, por ejemplo) o urinaria (como el biomarcador PCA3).
Se han diseñado diferentes calculadoras de riesgo de cáncer de próstata, ninguna de las cuales parece superior a las otras, por lo que cuál utilizar depende de las preferencias del profesional:
-
- Calculadora del Riesgo de Cáncer de Próstata (Prostate Cancer Risk Calculator-PCPTRC) del Estudio Clínico de la Prevención del Cáncer de Próstata (Prostate Cancer Prevention Trial-PCPT).
- Calculadoras de la Prostate Cancer Research Foundation, basadas en el European Randomized Study of Screening for Prostate Cancer.
Estas herramientas toman en cuenta factores como la raza, la edad, el PSA total y el porcentaje de PSA libre (cuanto menor sea, mayor probabilidad de cáncer), entre otros.
La velocidad de aumento del PSA y el tiempo de duplicación apenas tienen valor diagnóstico actualmente.
- La decisión de detener el seguimiento se tomará en función del estado funcional y la esperanza de vida (si es <15 años, el beneficio es improbable).
La Asociación Americana de Urología22 recomienda lo siguiente:
- En hombres entre 55 y 69 años, aconseja un modelo de decisión compartida, procediendo según las preferencias del paciente.
- En aquellos hombres que opten por el cribado, el seguimiento se hará cada 2 años, aunque este intervalo se ajustará según el valor del PSA.
- Fuera de este rango de edad, no se recomienda el cribado, excepto en hombres entre 40 y 54 años con elevado riesgo de cáncer de próstata, en cuyo caso la decisión debe individualizarse.
La US Preventive Services Task Force (USPSTF) recomienda lo siguiente21:
- En hombres entre 55 y 69 años, aconseja que la decisión sea personal, tras analizar con el paciente los potenciales beneficios y perjuicios.
- No recomienda el cribado en >70 años.
- No encuentra evidencia suficiente para hacer recomendaciones diferentes para los afroamericanos, los hombres con antecedentes familiares de cáncer de próstata o los grupos de riesgo menores de 55 años.
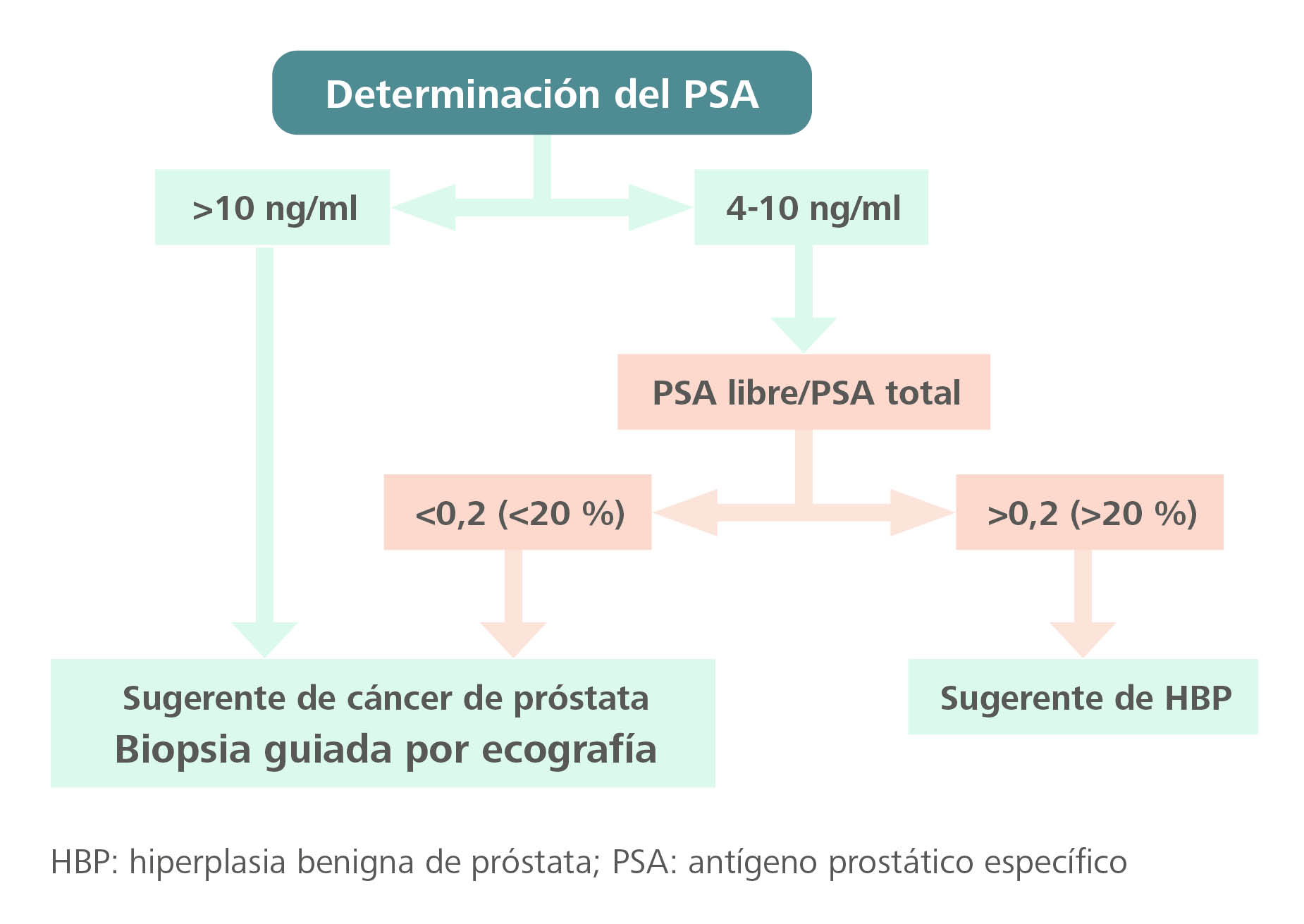
¿Cómo actuar según los valores de PSA?
El consenso para el abordaje de la HBP en atención primaria elaborado por la Asociación Española de Urología (AEU), la Sociedad Española de Medicina de Atención Primaria (Semergen), la Sociedad Española de Medicina Familiar y Comunitaria (SEMFYC) y la Sociedad Española de Médicos Generales y de Familia (SEMG) recomienda la actuación que se muestra en la figura 311.
Figura 3. Algoritmo de actuación según el resultado del antígeno específico prostático (PSA)
Fuente: Brenes Bermúdez et al.11
Antes de tomar cualquier decisión, el valor de PSA >4 ng/ml debe confirmarse a las 4-6 semanas, para descartar otras causas de elevación transitoria del PSA11.
Otras pruebas de evaluación diagnóstica de la hiperplasia benigna de próstata
Otras pruebas de diagnóstico que pueden ser útiles y que deben valorarse de manera personalizada en cada paciente son las siguientes:
- Funcionamiento renal. La creatinina sérica o el filtrado glomerular deben determinarse si la evaluación clínica o la presencia de hidronefrosis o de residuo posmiccional significativo hacen sospechar insuficiencia renal. El funcionamiento renal también debe valorarse si se sopesa el tratamiento quirúrgico2.
- Residuo posmiccional (RPM). Se puede medir mediante ecografía abdominal (preferiblemente)11 o cateterización. Lo normal es por debajo de 12 ml10, pero tiene gran variabilidad interindividual y no se ha establecido un umbral que permita tomar decisiones terapéuticas2. Se considera patológico el RPM >50 ml11; respecto a cuándo preocuparse, en algunas fuentes bibliográficas se habla de que la mayoría de los urólogos se preocupan si el RPM es >100-150 ml1; otras hablan de 250 ml10, y otras de 150 ml11. En cualquier caso, el valor basal elevado se asocia a mayor riesgo de progresión de los síntomas2.
La utilidad principal del RPM radica en que el aumento a lo largo del tiempo ayuda a identificar a los pacientes con riesgo alto de retención aguda de orina23 y puede traducir la ineficacia del tratamiento o la necesidad de cirugía8,10. Suele indicarse en los pacientes con mayor riesgo de progresión (síntomas moderados a intensos)11.
- Ecografía abdominal (o transrectal). La valoración ecográfica de la próstata está indicada solo cuando el volumen prostático condiciona el tratamiento (inhibidores de la reductasa 5α, cirugía). La ecografía también es útil cuando se sospechan complicaciones (cuadro 2), ya que permite valorar el aparato urinario10,11. El cuadro 2 muestra las indicaciones de la ecografía abdominal en pacientes con STUI.
Cuadro 2. Indicaciones de ecografía abdominal en varones con síntomas del tracto urinario inferior
| Cuando afecta a la elección del tratamiento (pacientes con síntomas moderados o graves)
Sospecha de residuo posmiccional patológico Sospecha de uropatía obstructiva Sospecha de patología neurológica Macro o microhematuria Globo vesical Antecedentes de urolitiasis |
Fuente: Brenes Bermúdez et al.11
- Flujometría. Es una prueba urodinámica no invasiva que evalúa el flujo urinario máximo. La precisión diagnóstica varía según el punto de corte2: en general, un flujo máximo <10 ml/s indica obstrucción; entre 15 y 10 ml/s sugiere obstrucción; ≥15 ml/s se considera normal11, aunque tampoco puede descartarse obstrucción, ya que pueden estar actuando mecanismos fisiológicos compensatorios. Tiene poca utilidad diagnóstica, ya que no discrimina la causa de la obstrucción (HBP o disfunción del detrusor, entre otras)2.
La flujometría puede usarse para correlacionar los síntomas con los datos objetivos de obstrucción, sobre todo cuando no concuerdan, y para monitorizar la eficacia del tratamiento2,11.
Tratamiento
¿Cómo se trata la hiperplasia benigna de la próstata?
Los síntomas de la HPB tienden a progresar a lo largo de los años, más cuanto mayores son los pacientes10.
A largo plazo, la mayoría de los pacientes sin tratamiento presentarán un empeoramiento de los síntomas y la calidad de vida y un aumento de la incidencia de complicaciones (disfunción vesical irreversible, insuficiencia renal, infecciones recurrentes, litiasis, hematuria y retención aguda de orina) y de la necesidad de cirugía11. No obstante, algunos pueden permanecer estables durante años2 o, incluso, mejorar10.
Por tanto, el tratamiento se decidirá de forma personalizada y consensuada con el paciente, tras establecer la intensidad de los síntomas y el riesgo de progresión e informarle de los beneficios y riesgos de cada tratamiento11.
Las opciones incluyen el tratamiento higiénico-dietético, el farmacológico y el quirúrgico.
¿Cuál es el tratamiento higiénico-dietético de la hiperplasia benigna de la próstata?
Las intervenciones relacionadas con los hábitos de vida (cuadro 3) pueden enlentecer la progresión y reducir la intensidad de los STUI11. Están indicadas en todos los pacientes, con independencia de que se asocie o no otro tipo de tratamiento24.
Cuadro 3. Medidas higiénico-dietéticas para el tratamiento de la hiperplasia benigna de la próstata
| Informar al paciente
• Explicar la naturaleza de la enfermedad y los síntomas, y tranquilizar sobre el cáncer de próstata. |
| Restringir y adecuar la ingesta de líquidos
• No beber al menos 2 horas antes de acostarse o de hacer alguna actividad en la que no se pueda encontrar un baño. |
| Cambios dietéticos y de hábitos de vida
• No beber cafeína ni alcohol, pues son diuréticos. • Restringir los picantes y las grasas y aumentar las verduras. • Evitar el estreñimiento. • Adelgazar, si existe sobrepeso u obesidad. • Hacer ejercicio físico. |
| Revisar la medicación
• Optimizar el momento de la administración (diuréticos). • Sustituir algunos fármacos, si es posible (diuréticos, antihistamínicos, antidepresivos, antagonistas del calcio). |
| Hábitos miccionales y entrenamiento vesical
• Tomarse el tiempo necesario para vaciar por completo la vejiga. • Después de orinar, esperar 2 o 3 minutos y volver a intentarlo (técnica del doble vaciado vesical). • Exprimir la uretra al final de la micción, para vaciarla y prevenir el goteo. Para ello, se coloca la yema de los dedos unos 3 cm detrás del escroto. Se presiona suavemente moviendo los dedos adelante, hacia la base del pene. Este movimiento se repite 2 o 3 veces. • Para disminuir la sensación de urgencia, se puede reentrenar la vejiga para aguantar cada vez un poco más cuando se sienten ganas de orinar, con el fin de aumentar la capacidad de la vejiga (unos 400 ml) y alargar el tiempo entre micciones. • Instruir a los hombres con síntomas obstructivos para orinar de forma programada (cada 90-120 minutos por el día), en vez de esperar a sentir ganas. • Utilizar técnicas de distracción y relajación, como comprimir el pene, practicar ejercicios respiratorios, presionar el periné o hacer «trucos mentales» para controlar los síntomas irritativos. |
Fuente: Gravas et al.2, Brenes Bermúdez et al. 11, Mayo Clinic25, Mersey Care NHS Foundation Trust26.
¿Qué fármacos hay para tratar la hiperplasia benigna de la próstata?
El tratamiento farmacológico está indicado en pacientes con síntomas de intensidad moderada a grave que repercuten en la calidad de vida, en ausencia de complicaciones e indicación absoluta de cirugía11.
Los fármacos cuya eficacia para tratar los STUI/HBP está demostrada (tabla 3) son los bloqueantes de los receptores adrenérgicos α1, los inhibidores de la reductasa 5α (5‑ARI), los inhibidores de la fosofodiesterasa 5 (IPDE-5) y los antimuscarínicos11. Los agonistas de los receptores adrenérgicos β3 podrían ser una alternativa a los antimuscarínicos, aunque existen pocos datos24. Además, se utiliza también la fitoterapia, aunque su eficacia es controvertida11,24.
Tabla 3. Características de los fármacos usados para la hiperplasia benigna de la próstata
| Fármaco | Rapidez de inicio | Mejoría STUI (IPSS) | Aumento Qmáx | Disminución del tamaño prostático | Disminución del VRP | Disminución de la progresión clínica o las complicaciones |
| Bloqueante α | Días | ++ | ++ | -/+ | +++ síntomas | |
| 5-ARI | Meses | + | ++ | +/++ | – | +++ síntomas
+++ RAO, cirugía |
| Bloqueante α + 5-ARI | Días | ++ | ++ | +/++ | -/+ | +++ síntomas
+++ RAO, cirugía |
| IPDE-5 | Días | ++ | +/- | -/+ | ? | |
| Bloqueante α + AM | Días | ++ | ++ | ? |
5-ARI: inhibidores de la reductasa 5α; AM: antimuscarínico; IPDE-5: inhibidores de la fosofodiesterasa 5 (tadalafilo); IPSS: escala internacional de síntomas prostáticos; Qmáx: flujo máximo; RAO: retención aguda de orina; STUI: síntomas del tracto urinario inferior; VRP: volumen residual posmiccional.
Fuente: Brenes Bermúdez et al.11
Bloqueantes de los receptores adrenérgicos α1
Reducen el tono del musculo liso prostático y, por tanto, la obstrucción infravesical, sin afectar al músculo detrusor de la pared vesical2,11. Sus principales características (tabla 4) son las siguientes:
- Rápido inicio de acción: el efecto completo tarda unas semanas, pero se puede notar mejoría los primeros días o incluso horas2,11.
- Reducen el IPSS 3-7 puntos (un 30 %-50 %, frente al 10 %-20 % del placebo), aumentan el flujo máximo urinario un 20 %-25 % (frente al 10 %-15 % del placebo) y disminuyen el volumen residual posmiccional11.
- Mejoran los síntomas tanto de vaciado como de llenado2.
- Son igualmente eficaces en todos los grupos de edad2,11.
- La eficacia a corto plazo no depende del tamaño prostático, pero a largo plazo parece ser superior cuando el volumen es <40 ml2,11.
- La eficacia entre ellos es muy parecida, aunque la silodosina se diferencia en que mejora la nicturia, reduciendo significativamente los episodios11,27.
- No modifican el PSA2,11.
- No disminuyen el volumen prostático ni previenen la retención aguda de orina ni la necesidad de cirugía2,11.
- Los efectos adversos más frecuentes son la astenia, el mareo y la hipotensión ortostática2. Debe extremarse la precaución con los pacientes ancianos11.
- Los bloqueantes α difieren en la tolerabilidad (tabla 5). Los efectos vasodilatadores son más intensos con la doxazosina y la terazosina, y menos con la alfuzosina y la tamsulosina2. Por su parte, la silodosina se distingue de otros bloqueantes α1 por su mayor selectividad para el receptor α1A en relación con los subtipos α1B y α1D. Por ello, se asocia con una menor incidencia de eventos adversos cardiovasculares (como hipotensión ortostática), incluso en pacientes con comorbilidades o tratados con antihipertensivos27,28.
- Pueden causar eyaculación anormal (probablemente sea más frecuente con la silodosina), pero no afectan negativamente a la libido y tienen un pequeño efecto beneficioso sobre la función eréctil11.
- Deben evitarse al menos 2 semanas antes de la cirugía de cataratas (sobre todo, tamsulosina, alfuzosina y doxazosina), por el riesgo de síndrome del iris flácido11.
- Los menos uroselectivos (terazosina, doxazosina y alfuzosina) deberían darse por la noche, ajustando la dosis de forma progresiva11.
- Es preferible utilizar los bloqueantes α uroselectivos de duración prolongada11.
Tabla 4. Principales características de los bloqueantes α
| Fármaco | Dosis | Observaciones |
| Terazosina | • Inicial: 1 mg.
• Siguientes: a los 3-4 días, aumentar a 2 mg hasta acabar la caja; seguir aumentando 1 mg cada 3-7 días hasta la dosis de mantenimiento. • Mantenimiento: 5 mg (máximo 10 mg). |
• Efecto hipotensor.
• Mejora el perfil lipídico. • Presentaciones: 2 mg, 5 mg, 10 mg. |
| Doxazosina | • Inicial: 1 mg.
• Siguientes: aumentar cada 1 o 2 semanas hasta la dosis de mantenimento. • Mantenimiento: 2 a 4 mg (máximo 8 mg). |
• Mayor efecto hipotensor.
• Presentaciones: 2 mg, 4 mg, 4 mg de liberación controlada. |
| Alfuzosina | • 2,5 mg/8 h o 5 mg/12 h o 10 mg/24 h (en ancianos, empezar con 2,5 mg/12 h o 5 mg/24 h). | • Efectos adversos más
parecidos a los uroselectivos. • Presentaciones: 2,5 mg, 5 mg y 10 mg de liberación prolongada. |
| Tamsulosina | • 0,4 mg/24 h. | • Menor efecto hipotensor.
• Se puede usar con IPDE‑5. • Presentaciones: 0,4 mg, 0,4 mg en liberación prolongada (OCAS) |
| Silodosina | • 8 mg/24 h (4 mg en pacientes con
insuficiencia renal moderada). |
• Mayor rapidez de acción.
• Menos efectos cardiovasculares. • Se puede usar con IPDE‑5. • Presentaciones: 4 mg, 8 mg. |
Fuente: Brenes Bermúdez et al.11; Fichas técnicas de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Tabla 5. Principales efectos adversos de los bloqueantes α
| Fármaco | Frecuentes
1 % al 10 % |
Poco frecuentes
0,1 % al 1 % |
| Terazosina | Mareo, somnolencia, cefalea, vértigo.
Visión borrosa/ambliopía. Hipotensión postural. Disnea, congestión nasal, rinitis. Náuseas. Impotencia. Astenia. |
Edema periférico.
Palpitaciones, síncope, taquicardia, hipotensión. Disminución de la libido. Ganancia de peso. |
| Doxazosina | Mareo, somnolencia, cefalea, vértigo.
Hipotensión, hipotensión postural. Palpitaciones, taquicardia. Infección del tracto respiratorio, infección del tracto urinario. Bronquitis, tos, disnea, rinitis. Dolor abdominal, dispepsia, boca seca, náuseas. Prurito. Dolor de espalda, mialgia. Cistitis, incontinencia urinaria. Astenia, dolor torácico, enfermedad de tipo gripal, edema periférico |
Reacción alérgica.
Anorexia, gota, aumento del apetito. Ansiedad, depresión, insomnio. Angina de pecho, infarto de miocardio. Accidente cerebrovascular, hipoestesia, síncope, temblor. Acúfenos. Epistaxis. Estreñimiento, diarrea, flatulencia, vómitos, gastroenteritis. Pruebas de función hepática anormales. Erupción cutánea. Artralgia. Disuria, hematuria, micciones frecuentes. Impotencia. Dolor en el sitio de inyección, edema facial. Aumento de peso. |
| Alfuzosina | Mareo, cefalea, vértigo.
Hipotensión postural. Astenia, malestar. Náuseas, dolor abdominal, diarrea, sequedad de boca. |
Taquicardia, palpitaciones.
Síncope, somnolencia. Visión anómala. Edema, dolor torácico. Vómitos. Rinitis. Rash, prurito. Sofocos. |
| Tamsulosina | Mareo.
Alteraciones de la eyaculación, eyaculación retrógrada, insuficiencia eyaculatoria. |
Cefalea.
Palpitaciones. Hipotensión ortostática. Rinitis. Estreñimiento, diarrea, náuseas, vómitos Erupción, prurito, urticaria. Astenia. |
| Silodosina | Muy frecuentes: Trastornos de la eyaculación (eyaculación retrógrada, aneyaculación).
Mareo. Hipotensión ortostática. Congestión nasal. Diarrea. |
Disminución de la libido.
Taquicardia, hipotensión. Náuseas, sequedad de boca. Disfunción eréctil. |
Fuente: Fichas técnicas de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Los bloqueantes α se consideran el tratamiento de primera línea para la mayoría de los hombres con STUI moderados a graves debido a su inicio de acción rápido, su eficacia y la baja frecuencia de efectos adversos, generalmente leves2,11,24.
Inhibidores de la reductasa 5α
La finasterida y la dutasterida son inhibidores selectivos, competitivos e irreversibles de la reductasa 5α, por lo que reducen la concentración de dihidrotestosterona, con la consecuente reducción del crecimiento glandular y mejoría de la obstrucción al flujo de salida vesical11.
Sus principales características son las siguientes:
- Inicio de acción lento: los efectos comienzan a verse a partir de los 6 meses (entre 3-6 meses con dutasterida), y el máximo beneficio se obtiene a partir del año11. Por tanto, solo son adecuados para el tratamiento de larga duración (años)2.
- A los 2-4 años, mejoran el IPSS un 15 %-30 %, aumentan el flujo máximo urinario 1,5-2 ml/s y reducen el volumen prostático un 18 %-28 %2.
- La respuesta clínica y flujométrica es similar a la de los bloqueantes α, pero reducen el riesgo de retención aguda de orina y la necesidad de cirugía a largo plazo11.
- La finasterida y la dutasterida se han mostrado igual de efectivas2,11, aunque la dutasterida actúa más rápido (a partir del tercer mes)11.
- La eficacia depende del volumen prostático: la finasterida no parece eficaz en próstatas <40 ml, mientras que la dutasterida ha mostrado su eficacia también en tamaños de 30 ml a 40 ml2,11.
- Reducen la concentración sérica de PSA ≈50 % de 6 a12 meses después de empezar el tratamiento11.
- Los 5-ARI disminuyen el riesgo de cáncer de próstata de bajo grado. Aunque los resultados son contradictorios con respecto a los de alto grado (Gleason ≥ 7), no se ha probado que exista una relación causal11.
- Los efectos adversos más frecuentes se relacionan con la esfera sexual (disminución de la libido, disfunción eréctil y descenso del volumen del semen)2.
Tabla 6. Principales características de los inhibidores de la reductasa 5α
| Característica | Finasterida | Dutasterida |
| Dosis | • 5 mg/24 h, con o sin alimentos.
• No necesita ajuste de dosis en ancianos ni en IR. |
• 0,5 mg/24 h, con o sin alimentos.
• No necesita ajuste de dosis en ancianos ni en IR. |
| Inicio de acción | • A los 6-12 meses.
|
• A los 3-6 meses |
| Volumen prostático | • Eficaz si el volumen prostático es >40 ml. | • Eficaz si el volumen prostático es >30 ml. |
| Efectos adversos | Frecuentes (1 % al 10 %) | |
| Disminución de la libido.
Impotencia. Disminución del volumen de la eyaculación. |
Disminución de la libido.
Impotencia. Trastornos de la eyaculación. Trastornos de la mama. |
|
| Poco frecuentes (0,1 % al 1 %) | ||
| Erupción cutánea.
Trastornos de la eyaculación, hipersensibilidad mamaria, crecimiento mamario. |
Alopecia (principalmente pérdida de pelo corporal), hipertricosis | |
| Frecuencia desconocida | ||
| Reacciones alérgicas.
Depresión, ansiedad. Palpitaciones. Elevación de las enzimas hepáticas. Prurito, urticaria. |
Reacciones alérgicas.
Depresión. Dolor e inflamación testicular. |
|
Fuente: Brenes Bermúdez et al.11; Fichas técnicas de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Los 5-ARI están indicados para el tratamiento a largo plazo en los pacientes con STUI moderados a graves y riesgo alto de progresión de la HBP, definido por un volumen prostático >40 ml o una concentración de PSA >1,4-1,6 ng/ml2,11.
Inhibidores de la fosfodiesterasa 5
Los IPDE-5reducen el IPSS y los síntomas de llenado y vaciado y mejoran la calidad de vida en pacientes con HBP con o sin disfunción eréctil asociada, pero no aumentan el flujo máximo urinario2. Por otro lado, hay que tener en cuenta que entre el 50 % y el 70 % de los hombres con HBP pueden sufrir algún grado de disfunción eréctil11.
Los efectos adversos más frecuentes son la cefalea, el dolor de espalda, el rubor facial y la dispepsia. Están contraindicados en pacientes con episodios isquémicos recientes, hipotensión, tensión arterial mal controlada, insuficiencia renal o hepática importantes, neuropatía óptica isquémica anterior o tratamiento concomitante con nitratos, doxazosina o terazosina11.
El tadalafilo en dosis de 5 mg diarios es una alternativa en hombres con STUI moderados a graves, especialmente los afectos de disfunción eréctil11. Los hombres que más parecen beneficiarse son los jóvenes con un índice de masa corporal bajo y STUI intensos2.
Antagonistas de los receptores muscarínicos
Los antimuscarínicos (solifenacina, tolterodina, fesoterodina) son útiles en hombres con síntomas predominantemente de llenado, ya que mejoran la urgencia, la incontinencia de urgencia y la polaquiuria2.
A pesar del teórico riesgo de retención de orina, los resultados de varios ensayos han apoyado la eficacia y la seguridad de los antimuscarínicos en el tratamiento de hombres con STUI sin volumen residual posmiccional elevado2,11. Sin embargo, antes de usarlos deben descartarse situaciones que indiquen riesgo de retención aguda de orina11:
- Aumento del volumen prostático (>50 ml)
- PSA sérico >1,4 ng/ml
- Flujo urinario máximo <10 ml/s
- IPSS >19 puntos
- Volumen residual posmiccional >150 ml
Se recomienda monitorizar el volumen residual posmiccional durante el tratamiento2, cada 4-6 meses11.
Los efectos adversos más frecuentes son la boca seca, el mareo y el estreñimiento2.
Los antimuscarínicos en monoterapia podrían estar indicados en hombres con STUI exclusivamente de llenado y vejiga hiperactiva, sin datos que indiquen riesgo de retención aguda de orina11.
Fitoterapia
De los más de 30 compuestos de fitoterapia que existen para el tratamiento de la HBP, los más usados son Serenoa repens y Pygeum africanum11.
Existe gran controversia sobre su eficacia clínica. Los preparados son muy heterogéneos en cuanto a composición, presentaciones y concentraciones, lo cual dificulta su estudio y comparación, incluso entre diferentes marcas de extractos de la misma planta2,11.
En la actualidad, no existe información de calidad suficiente para recomendar los productos fitoterápicos2,11,24,29.
Agonistas de los receptores adrenérgicos β3
El mirabegrón es el único fármaco de este tipo actualmente en el mercado. Apenas existen datos sobre su uso en los STUI, pero puede ser una opción en pacientes con síntomas principalmente de llenado2. Tienen menos riesgo de estreñimiento y xerostomía, por lo que son una alternativa para los pacientes candidatos a tratamiento con antagonistas de los receptores muscarínicos que quieren evitar estos efectos adversos30.
Esta clase de medicamentos puede causar hipertensión, por lo que debe evaluarse la tensión arterial de forma periódica2,24,30.
El mirabegrón puede ser una opción en pacientes con síntomas moderados a graves de llenado2.
Bloqueantes α + inhibidores de la 5α-reductasa
En comparación con la monoterapia, la combinación mejora los STUI y aumenta el flujo máximo de forma importante, y también es más eficaz en prevenir la progresión, la retención aguda de orina y la necesidad de cirugía a largo plazo. No obstante, también la frecuencia de efectos adversos con la terapia combinada es significativamente mayor que con la monoterapia2,11.
Por tanto, el tratamiento combinado con un bloqueante α y un 5-ARI debe ofrecerse a hombres con STUI moderados a graves y gran riesgo de progresión, siempre que la intención sea mantener el tratamiento a largo plazo2,11.
En este sentido, las guías difieren ligeramente en lo que significa «riesgo de progresión». La guía de la UEA habla de tamaño prostático >40 ml, notable aumento del PSA, edad avanzada, elevado residuo posmiccional, descenso importante del flujo máximo, etc. Asimismo, especifica que no se debe dar esta terapia si se espera que el tratamiento dure menos de 12 meses2.
Por su parte, el consenso español recomienda combinar un bloqueante α y un 5-ARI para el tratamiento a largo plazo (4-7 años) de los pacientes con síntomas moderados a graves (IPSS ≥8 puntos) con otros factores de riesgo de progresión clínica: volumen prostático ≥30 ml y PSA ≥1,5 ng/dl11.
Una vez iniciado el tratamiento combinado no se justifica retirar el bloqueante α, pues los beneficios de la combinación se mantienen e incluso se amplían a largo plazo11.
Bloqueantes α + antagonistas de los receptores muscarínicos
Esta combinación podría ser útil en pacientes con síntomas moderados a graves en quienes persisten síntomas de llenado a pesar del tratamiento con bloqueantes β11.
Antes de empezar el tratamiento se deben descartar situaciones que indiquen riesgo alto de obstrucción del tracto urinario inferior, y se debe monitorizar el volumen residual posmiccional cada 4-6 meses11.
Aunque es posible que la adición de mirabegrón a un bloqueante α sea efectiva y bien tolerada para mejorar los síntomas de llenado, los estudios son insuficientes para poder recomendar esta asociación2,24.
Tratamiento quirúrgico de la hiperplasia benigna de la próstata
El tratamiento quirúrgico se recomienda si el paciente ha sufrido retención urinaria recurrente o refractaria, incontinencia por rebosamiento, infecciones urinarias recurrentes, litiasis o divertículos vesicales, hematuria, insuficiencia renal o dilatación del tracto urinario superior secundaria a obstrucción prostática. También son candidatos los pacientes que no han obtenido suficiente alivio de los síntomas con el tratamiento médico2,23,31.
La resección transuretral (mediante electrocauterización monopolar o bipolar, a elegir según la experiencia del cirujano23) es el método quirúrgico más usado hoy en día y se recomienda para los pacientes con indicación quirúrgica y tamaño prostático entre 30 ml y 80 ml2,23. La incisión transuretral es adecuada para próstatas <30 ml sin lóbulo medio2.
La prostatectomía abierta es el método más invasivo, pero es eficaz y duradero. Puede producir incontinencia urinaria transitoria hasta en el 10 % de los pacientes, y estrechamiento del cuello vesical o estenosis uretral en alrededor del 6 %. La enucleación endoscópica es menos invasiva, por lo que es preferible cuando se dispone del material adecuado y de personal con experiencia. Ambos métodos están indicados cuando la próstata es mayor de 80 ml2.
Otros métodos menos invasivos son, por ejemplo, la termoterapia transuretral con microondas —una opción para pacientes mayores con comorbilidades o riesgo anestésico elevado— y la ablación transuretral con aguja, menos eficaz que la resección transuretral2.
Un procedimiento igual de eficaz que la resección transuretral, pero con menos efectos adversos, es la enucleación prostática con láser Ho:YAG. Es una alternativa a la resección transuretral y a la prostatectomía abierta cuando se dispone de los medios necesarios. La experiencia del cirujano es el factor que más influye en la tasa de complicaciones. Existen también otros tipos de láser que pueden usarse2.
El stent prostático tiene una utilidad limitada, ya que causa efectos adversos y en muchos casos se desplaza. Puede ser una opción temporal para disminuir los STUI en los pacientes a la espera de una intervención quirúrgica2.
La cirugía de liberación uretral (Urolift®) es una intervención ambulatoria mínimamente invasiva en la cual se coloca un implante que sujeta los lóbulos laterales de la próstata, por lo que se abre el canal uretral. Mejora el IPSS, el flujo máximo y la calidad de vida, y no afecta a la función sexual. Según la guía de la EAU, este sistema puede ofrecerse a los pacientes con una próstata <70 ml (<80 ml, según la Asociación Americana de Urología23) sin lóbulo medio que quieran preservar las funciones sexuales. Debe advertírseles que no se conocen los efectos a largo plazo, incluida la necesidad de reintervención2.
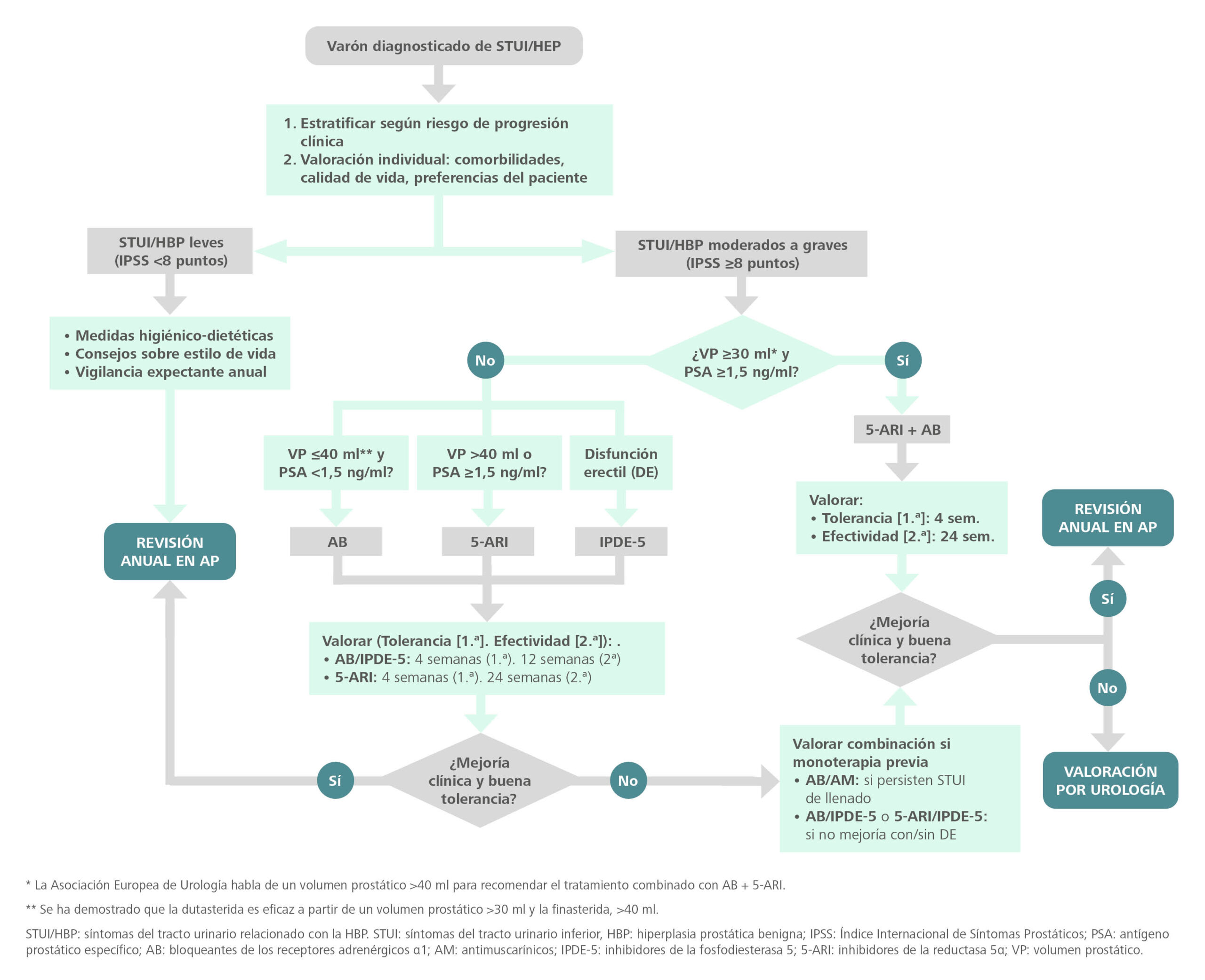
¿Qué tratamiento elegir?
La figura 4 muestra el algoritmo de tratamiento propuesto por el consenso español11.
Figura 4. Algoritmo de tratamiento de la hiperplasia benigna de próstata
Fuente: adaptado de Brenes Bermúdez et al.11
Seguimiento del paciente con hiperplasia benigna de la próstata
En cuanto al seguimiento, la periodicidad y las actividades de cada visita dependen del tipo de tratamiento.
El consenso español recomienda lo siguiente11:
- Conducta expectante:
- Revisión anual.
- En cada visita: anamnesis, IPSS.
- Pacientes con tratamiento farmacológico sin 5-ARI:
- Primera revisión (se evalúa la tolerancia): al mes del inicio del tratamiento.
- Segunda revisión (se evalúa la eficacia y la adherencia): a los 3 meses.
- Después: anual (se evalúa la eficacia y la adherencia).
- En cada visita: anamnesis, IPSS, valoración del cumplimiento terapéutico.
- Pacientes con 5-ARI:
- Primera revisión (se evalúa la tolerancia): al mes del inicio del tratamiento.
- Segunda revisión (se evalúa la eficacia y la adherencia): a los 6 meses.
- Después: anual (se evalúa la eficacia y la adherencia).
- En cada visita: anamnesis, IPSS, PSA, valoración del cumplimiento terapéutico. El valor del PSA se reduce al 50 % de su valor inicial tras 6 meses de tratamiento con un 5-ARI y sigue descendiendo al menos el primer año. Cuando no se consigue esta reducción, suele deberse a la falta de adherencia.
Si en la primera revisión los efectos adversos son importantes, se cambiará de tratamiento.
Si en la segunda revisión la respuesta al tratamiento se considera insuficiente (el IPSS no se reduce ≥4 puntos), se valorará modificar el tratamiento o remitir a urología.
Si en la tercera revisión (al año) hay un empeoramiento de los síntomas (aumento del IPSS ≥4 puntos), se valorará modificar el tratamiento o remitir a urología.
A partir de ahí, si en un paciente clínicamente estable empeoran los síntomas (aumento del IPSS ≥4 puntos), está indicado reevaluar al paciente con el mismo protocolo que en el diagnóstico inicial: exploración física, sedimento de orina, bioquímica (glucemia, creatinina y PSA) y ecografía urológica-abdominal. Según los resultados, se valorará cambiar de tratamiento o derivar a urología.
Se considera una buena respuesta al tratamiento la reducción de la puntuación del cuestionario IPSS ≥4 puntos11.
Por su parte, la Asociación Europea de Urología recomienda lo siguiente, sin especificar si este seguimiento se hace en atención primaria o en urología2:
- Conducta expectante (pacientes con STUI que afectan poco a la calidad de vida):
- Primera revisión: a los 6 meses, luego anual.
- En cada visita: anamnesis, IPSS, uroflujometría, residuo posmiccional.
- Pacientes con bloqueantes α1, antimuscarínicos, agonistas β3, IPDE-5, combinación de bloqueantes α1 con inhibidores de la reductasa 5α o con antimuscarínicos:
- Primera revisión: a las 4-6 semanas del inicio del tratamiento.
- Segunda revisión: a los 6 meses.
- Después: anual.
- En cada visita: anamnesis, IPSS, uroflujometría, residuo posmiccional.
- Pacientes con inhibidores de la reductasa 5α:
- Primera revisión: a las 12 semanas del inicio del tratamiento.
- Segunda revisión: a los 6 meses.
- En cada visita: anamnesis, IPSS, uroflujometría, residuo posmiccional.
- Si la esperanza de vida es mayor de 10 años y diagnosticar cáncer de próstata repercutirá en el tratamiento, se debe hacer una determinación del PSA a los 6 meses del inicio del tratamiento (nuevo PSA basal) y después de forma periódica. Cualquier alteración del PSA debe estudiarse.
- Pacientes con tratamiento quirúrgico:
- Primera revisión: 4-6 semanas tras la retirada de la sonda.
- En la primera visita: IPSS, uroflujometría, residuo posmiccional.
- Las revisiones posteriores son innecesarias si los síntomas han mejorado y no hay efectos adversos.
¿Cuándo derivar al paciente con hiperplasia benigna de próstata?
El consenso español propone los siguientes criterios de derivación de atención primaria a urología11:
- Edad inferior a 50 años.
- Antecedentes de cirugía pélvica.
- Posibles alteraciones uretrales (por enfermedades de transmisión sexual, instrumentación o traumatismos uretrales).
- Diabetes mellitus mal controlada con neuropatía y afectación
- Enfermedades neurológicas (enfermedad de Parkinson, esclerosis múltiple, ictus, lesiones medulares, etc.).
- Sospecha de cáncer de próstata:
- Tacto rectal patológico o PSA >10 ng/ml.
- PSA entre 4 y 10 ng/ml y PSA libre <20 %.
- Diagnóstico incierto.
- Divertículos vesicales.
- Hematuria persistente.
- Signos de retención crónica de orina.
- Retención aguda de orina.
- Residuo posmiccional >150 ml.
- Función renal alterada con sospecha de uropatía obstructiva, creatinina >1,5 mg/dl o filtrado glomerular alterado secundario a la obstrucción.
- Síntomas de HBP que no responden al tratamiento farmacológico, es decir, la disminución de la puntuación del cuestionario IPSS no llega a 4 puntos:
- Sin 5-ARI: después de 3 meses de tratamiento.
- Con 5-ARI: después de 6 meses de tratamiento.
- Empeoramiento de los síntomas (es decir, incremento de la puntuación del cuestionario IPSS ≥4 puntos durante el seguimiento), si la reevaluación del paciente lo indica.
- En pacientes tratados con 5-ARI, la elevación del PSA ≥0,3 ng/ml respecto al nivel más bajo de PSA obtenido durante el tratamiento, confirmada y mantenida a las 4-6 semanas. La EUA(2), por su parte, recomienda estudiar cualquier aumento del PSA respecto del basal en pacientes con 5-ARI.
Guías clínicas
Últimas guías publicadas
- Guía de la Sociedad Europea de Urología:
https://uroweb.org/guideline/treatment-of-non-neurogenic-male-luts/
Gravas S, Cornu JN, Drake MJ, Herrmann C, Gacci M, Gratzke TR, et al. EAU Guidelines. Management of Non-neurogenic Male LUTS. European Association of Urology. Edn. presented at the EAU Annual Congress Amsterdam 2020. 2020.
- Consenso sobre la atención del paciente con HBP en atención primaria, de la Asociación Española de Urología (AEU), la Sociedad Española de Medicina de Atención Primaria (Semergen), la Sociedad Española de Medicina Familiar y Comunitaria (SEMFYC) y la Sociedad Española de Médicos Generales y de Familia (SEMG):
http://mgyf.org/wp-content/uploads/2019/11/MGYF-Supl-HBP.pdf
Brenes Bermúdez FJ, Brotons Muntó F, Cozar Olmo JM, Fernández-Pro Ledesma A, Martín Jiménez JA, Martínez-Berganza Asensio ML, et al. Criterios de derivación en hiperplasia benigna de próstata. Med Gen y Fam. 2019; 8 (Supl. 1): p. 1-30.
- Guía elaborada por el National Institute for Health and Care Excellence (NICE):
https://www.nice.org.uk/guidance/cg97
NICE. Lower urinary tract symptoms in men: management. Clinical guideline [CG97]. NICE. 2010 [revisado y validado 2015].
- Guía canadiense de atención a la HBP:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6192748/
Nickel JC, Aaron L, Barkin J, Elterman D, Nachabé M, Zorn KC. Canadian Urological Association guideline on male lower urinary tract symptoms/benign prostatic hyperplasia (MLUTS/BPH): 2018 update. Can Urol Assoc J. 2018; 12 (10): 303-312.
- Guía de abordaje de la HBP, de la Asociación Americana de Urología:
McVary KT, Roehrborn CG, Avins AL, Barry MJ, Bruskewitz RC, Donnell RF, et al. Management of benign prostatic hyperplasia. American Urological Association. 2010 [revisado y validado 2014].
- Guía sobre el tratamiento quirúrgico de la HBP, de la Asociación Americana de Urología:
https://pubmed.ncbi.nlm.nih.gov/29775639/
Foster HE, Barry MJ, Dahm P, Gandhi MC, Kaplan SA, Kohler TS, et al. Surgical Management of Lower Urinary Tract Symptoms Attributed to Benign Prostatic Hyperplasia: AUA Guideline. J Urol. 2018; 200 (3): 612-619.
Recursos relacionados
- Consulta rápida: HBP: síntomas, complicaciones y calidad de vida
- Actualización: Preguntas frecuentes: Cuestionario IPSS para evaluar la HBP
- Revisión de artículos científicos: Síntomas del tracto urinario inferior en los hombres
- Formación: QUIZ: ¿Cuánto sabes de la hiperplasia benigna de próstata?
- Otros contenidos
Herramientas interactivas
Calculadora online del IPSS (en inglés): https://www.uptodate.com/contents/calculator-international-prostatism-symptom-score-ipss
Recursos para médicos
Recursos en línea y apps para médicos
Existen webs y aplicaciones para dispositivos móviles diseñadas para facilitar el abordaje de la hiperplasia benigna de próstata por parte de los profesionales.
Recursos relacionados
- Sección: Webs y apps para médicos
- Blog: Redes sociales para médicos y pacientes
- Blog: Cómo organizar las webs y los contenidos de internet
Webs de urología para médicos
Asociación Europea de Urología (European Association of Urology)
En la página oficial de la Asociación Europea de Urología se encuentran varios recursos en inglés:
Guías clínicas: últimas guías clínicas de urología, divididas en patologías oncológicas y no oncológicas. En su versión web, las guías son de acceso libre.
Formación online: cursos en línea acreditados, webinarios, etc. La mayoría son para socios, pero algunos son libres.
Otros recursos: por ejemplo, el URO-source, la mayor base de datos científica sobre urología, con más de 50 000 artículos.
Asociación Española de Urología (AEU)
La Asociación Española de Urología (AEU) es una sociedad científica sin ánimo de lucro que tiene como objetivo fomentar la investigación y el estudio de las patologías urológicas.
La asociación celebra actividades científicas que se pueden consultar en el apartado presentaciones de congresos y reuniones. Es posible, de manera directa o en diferido, visualizar las presentaciones mediante los webcasts.
Además, la asociación proporciona cuestionarios para pacientes con problemas urológicos en PDF, de acceso libre.
En la revista oficial de la asociación, Actas Urológicas Españolas, puedes encontrar artículos relacionados con el campo de urología tanto en inglés como en español.
Apps de urología para médicos
EAU Guidelines
Últimas guías clínicas actualizadas de la Asociación Europea de Urología (EAU). Permite encontrar de manera rápida información sobre el manejo, investigación y diagnóstico de una variedad de enfermedades urológicas. La aplicación también incluye calculadoras clínicas.
En inglés. Precisa introducir las claves de socio de la EAU.
Disponible para dispositivos Android.
Recursos para pacientes
Recursos en PDF para los pacientes
Descarga los consejos para pacientes con HBP
- HBP: consejos para vivir mejor
Almirallmed
Recursos en línea y apps para pacientes
El consejo del médico puede completarse recomendando webs y apps que sirvan a los pacientes para mejorar la información que tienen sobre su enfermedad, así como para apoyarlos en el cambio de los hábitos de vida y en la correcta toma del tratamiento.
Recursos relacionados
- Sección: Webs y apps para pacientes
- Blog: ¿Cómo usar las redes sociales para comunicarte con los pacientes?
Webs de urología para pacientes
Asociación Española de Urología (AEU)
La Asociación Española de Urología (AEU) ha desarrollado una página web sobre enfermedades urológicas, con contenido dirigido a pacientes. El apartado de la hiperplasia benigna de próstata presenta información general sobre la enfermedad, la epidemiología, el diagnóstico, el tratamiento y el pronóstico.
Asociación Europea de Urología (European Association of Urology)
A la página para pacientes de La Asociación Europea de Urología se puede acceder tanto en inglés como en español. Tiene información sobre los distintos tipos de cáncer urológico y otras enfermedades urológicas, incluida la hiperplasia benigna de próstata (que en la web llaman crecimiento benigno de próstata). En el apartado específico sobre esta enfermedad, se encuentra una explicación de la anatomía de la próstata y del crecimiento benigno. También se explica el diagnóstico y tratamiento de varias enfermedades urológicas.
MedlinePlus: hiperplasia benigna de próstata
La página de MedlinePlus está producida por la Biblioteca Nacional de Medicina de los Estados Unidos. Se dirige a pacientes, familiares y amigos. Tiene dos versiones, una en inglés y otra en español.
En la pestaña «Temas de salud» se pueden encontrar varios recursos para la hiperplasia benigna de próstata (aquí denominada agrandamiento de la próstata):
- Explicación de la anatomía de la próstata.
- Causas del agrandamiento y factores de riesgo.
- Explicación detallada de las pruebas diagnósticas y el tratamiento.
Bibliografía
- Menéndez Fernández AI, D’Elia G, Docavo Barrenechea-Moxo ML. Hiperplasia benigna de próstata. Fisterra [Internet]. 2018 [citado 1 feb 2021]. Disponible en: https://www-fisterra-com.bvcscm.a17.csinet.es/guias-clinicas/hiperplasia-benigna-prostata/
- Gravas S, Cornu JN, Drake MJ, Herrmann C, Gacci M, Gratzke TR, et al. EAU Guidelines. Management of Non-neurogenic Male LUTS. European Association of Urology. Edn. presented at the EAU Annual Congress Amsterdam 2020 [Internet]. 2020 [citado 3 feb 2021]. Disponible en: https://uroweb.org/guideline/treatment-of-non-neurogenic-male-luts/
- Parsons JK, Dahm P, Köhler T, et al. Surgical management of lower urinary tract symptoms attributed to benign prostatic hyperplasia: AUA Guideline amendment 2020. J Urol. 2020; 204: 799.
- McVary KT. Epidemiology and pathophysiology of benign prostatic hyperplasia. UpToDate [Internet]. 2021 [citado 3 feb 2021]. Disponible en: https://www.uptodate.com/contents/epidemiology-and-pathophysiology-of-benign-prostatic-hyperplasia
- Deters L. Benign Prostatic Hyperplasia (BPH). Medscape [Internet]. 2019 [citado 3 feb 2021]. Disponible en: https://emedicine.medscape.com/article/437359-overview#a5
- Komninos C, Mitsogiannis I. Obstruction-induced alterations within the urinary bladder and their role in the pathophysiology of lower urinary tract symptomatology. Can Urol Assoc J. 2014; 8 (7-8): E524-E530.
- Fusco F, Creta M, De Nunzio C, Iacovelli V, Mangiapia F, et al. Progressive bladder remodeling due to bladder outlet obstruction: a systematic review of morphological and molecular evidences in humans. BMC Urol. 2018; 18: 15.
- Lim K. Epidemiology of clinical benign prostatic hyperplasia. Asian J Urol. 2017; 4 (3): 148-151.
- McVary K, Saini R. Lower urinary tract symptoms in men. UpToDate [Internet]. 2021 [citado 3 feb 2021]. Disponible en: https://www.uptodate.com/contents/lower-urinary-tract-symptoms-in-men
- McVary K. Clinical manifestations and diagnostic evaluation of benign prostatic hyperplasia. UpToDate [Internet]. 2019 [citado 4 feb 2021]. Disponible en: https://www.uptodate.com/contents/clinical-manifestations-and-diagnostic-evaluation-of-benign-prostatic-hyperplasia
- Brenes Bermúdez FJ, Brotons Muntó F, Cozar Olmo JM, Fernández-Pro Ledesma A, Martín Jiménez JA, Martínez-Berganza Asensio ML, et al. Criterios de derivación en hiperplasia benigna de próstata. Med Gen y Fam [Internet]. 2019 [citado 4 feb 2021]; 8 (Supl. 1): 1-30. Disponible en: http://mgyf.org/criterios-de-derivacion-en-hiperplasia-benigna-de-prostata-para-atencion-primaria-5g-4a-ed/
- Brotons Muntó F. ¿Qué es y para qué sirve el cuestionario IPSS? LiveMed Iberia [Internet]. 2018 [citado 4 feb 2021]. Disponible en: https://www.livemed.in/blog/-/blogs/%C2%BFque-es-y-para-que-sirve-el-cuestionario-ipss-;jsessionid=1D714D8B349547DB255194A517470FE1?p_p_auth=7WtzY9jg
- Robles A, Garibay TR, Acosta E, Morales S. La próstata: generalidades y patologías más frecuentes. Revista de la Facultad de Medicina de la UNAM. 2019; 62 (4): 41-54.
- Rubinstein E, Gueglio G, Giudice C, Tesolin P. Hiperplasia prostática benigna. Evid Act Pract Ambul. 2013; 16 (4): 143-151.
- McVary KT, Roehrborn CG, Avins AL, Barry MJ, Bruskewitz RC, Donnell RF, et al. Management of benign prostatic hyperplasia. American Urological Association [Internet]. 2010 [revisado y validado 2014; citado 12 feb 2021]. Disponible en: https://www.auanet.org/guidelines-and-quality/guidelines/benign-prostatic-hyperplasia-(bph)-guideline
- Nickel JC, Aaron L, Barkin J, Elterman D, Nachabé M, Zorn KC. Canadian Urological Association guideline on male lower urinary tract symptoms/benign prostatic hyperplasia (MLUTS/BPH): 2018 update. Can Urol Assoc J. 2018; 12 (10): 303-312.
- Andriole G. Hiperplasia prostática benigna (HPB). Manual MSD, versión para profesionales. [Internet]. 2019 [citado 5 feb 2021]. Disponible en: https://www.msdmanuals.com/es/professional/trastornos-urogenitales/enfermedad-prost%C3%A1tica-benigna/hiperplasia-prost%C3%A1tica-benigna-hpb
- Roehrborn CG, Strand DW. Benign Prostatic Hyperplasia: Etiology, Pathophysiology, Epidemiology, and Natural History. In Partin A. Campbell-Walsh-Wein Urology. 12.ª ed. Philadelphia: Elsevier; 2021; p. 3305-3342.
- Ibarra M, Carretero ME. Hiperplasia benigna de próstata: abordaje integral. Boletín Farmacoterapéutico de Castilla La Mancha. 2018; XIX (3): 1-7.
- Mottet N, Conford P, van den Bergh RC, Briers E, De Santis M, Fanti S, et al. EAU Guidelines. Prostate cancer. Edn. presented at the EAU Annual Congress Amsterdam 2020. [Internet].; 2020 [citado 11 feb 2021]. Disponible en: https://uroweb.org/guideline/prostate-cancer/
- US Preventive Services Task Force. Screening for Prostate Cancer. US Preventive Services Task Force Recommendation Statement. JAMA. 2018; 319 (18): 1901-1913.
- Carter HB, Albertsen PC, Barry MJ, Etzioni R, Freedland SJ, Greene KL, et al. Early detection of prostate cancer: AUA Guideline. J Urol. 2013 [actualizado 2018]; 190: 419.
- Foster HE, Barry MJ, Dahm P, Gandhi MC, Kaplan SA, Kohler TS, et al. Surgical Management of Lower Urinary Tract Symptoms Attributed to Benign Prostatic Hyperplasia: AUA Guideline. J Urol. 2018; 200 (3): 612-619.
- McVary KT. Medical treatment of benign prostatic hyperplasia. UpToDate [Internet]. 2021 [citado 11 feb 2021]. Disponible en: https://www.uptodate.com/contents/medical-treatment-of-benign-prostatic-hyperplasia
- Mayo Clinic. Mayo Foundation for Medical Education and Research. HIperplasia prostática benigna. [Internet]. 2019 [citado 19 feb 2021]. Disponible en: https://www.mayoclinic.org/es-es/diseases-conditions/benign-prostatic-hyperplasia/symptoms-causes/syc-20370087
- Mersey Care NHS Foundation Trust. Bladder and Bowel Service. Post micturition dribble. Liverpool (Reino Unido): Mersey. [Internet]. s.f. [citado 19 feb 2021]. Disponible en: https://www.merseycare.nhs.uk/application/files/2916/7051/2857/post-micturition-dribble-dl-6-page.pdf
- Roehrborn CG, Cruz F, Fusco F. α1-Blockers in Men with Lower Urinary Tract Symptoms Suggestive of Benign Prostatic Obstruction: Is Silodosin Different? Adv Ther. 2016; 33 (12): 2110-2121.
- Montorsi F, Gandaglia G, Chapple C, Cruz F, Desgrandchamps F, Llorente C. Effectiveness and safety of silodosin in the treatment of lower urinary tract symptoms in patients with benign prostatic hyperplasia: A European phase IV clinical study (SiRE study). Int J Urol. 2016; 23: 572-579.
- Keehn A, Taylor J, Lowe FC. Phytotherapy for Benign Prostatic Hyperplasia. Curr Urol Rep. 2016; 17 (7): 53.
- Rossanese M, Crestani A, Inferrera A, Giannarini G, Bartoletti R, Tubaro A, et al. Medical treatment for benign prostatic hiperplasia. Where do we stand? Urologia. 2019; 86 (3).
- McVary KT. Surgical treatment of benign prostatic hyperplasia (BPH). UpToDate [Internet].; 2020 [citado 24 feb 2021]. Disponible en: https://www.uptodate.com/contents/surgical-treatment-of-benign-prostatic-hyperplasia-bph