- El estudio ha cumplido todos los criterios de valoración primarios y los secundarios principales
- Lebrikizumab ha mostrado un perfil de seguridad consistente con los estudios previos ya realizados en dermatitis atópica
- El año que viene se presentarán solicitudes reglamentarias a nivel mundial basadas en los datos del programa de ensayos clínicos de fase III
BARCELONA (ESPAÑA), 21 de diciembre de 2021. Lebrikizumab, un inhibidor de la citocina IL-13, mejoró significativamente la gravedad de la enfermedad cuando se combinó con corticosteroides tópicos (TCS) en personas con dermatitis atópica (DA) de moderada a grave en un tercer ensayo pivotal de fase III (ADhere) anunciado hoy por Almirall S.A. (BME: ALM). En la semana 16, el estudio alcanzó todos los criterios de valoración primarios y los secundarios clave.
Lebrikizumab es un nuevo anticuerpo monoclonal (mAb) en fase de investigación que se une a la IL-13 soluble con una afinidad alta, tiene una elevada biodisponibilidad y una larga vida media, y bloquea la señalización de la IL-13.1-5 En personas con DA, la proteína IL-13 -un mediador patogénico central de la enfermedad- está sobreexpresada, impulsando múltiples aspectos de la fisiopatología de la DA al promover la inflamación de las células T colaboradoras (T-helper) tipo 2 (Th2) y dando lugar a la disfunción de la barrera cutánea, al picor, a la infección y a zonas duras y engrosadas de la piel6,7
«Los signos y síntomas de la DA difieren según las características individuales del paciente y, dependiendo de la gravedad, pueden afectar a su sueño, a sus actividades sociales y a su bienestar general. Los pacientes necesitan opciones de tratamiento eficaces y bien toleradas que permitan controlar la enfermedad a largo plazo y tener una calidad de vida óptima», ha afirmado el profesor y doctor en Medicina Andreas Pinter, director de Investigación Clínica del Hospital Universitario de Frankfurt/Main (Alemania) y uno de los investigadores del ensayo ADhere. «Lebrikizumab ha demostrado recientemente su eficacia potencial en monoterapia. Ahora, los datos de ADhere también han demostrado su efecto sobre la mejora de la piel y el alivio del picor como parte de una terapia combinada, lo que sugiere que el medicamento podría convertirse en una nueva opción de tratamiento para esta enfermedad cutánea crónica inmunomediada.»
Los criterios de valoración primarios fueron la puntuación de la Evaluación Global del Investigador (IGA) de «aclaramiento total de la piel» (0) o «aclaramiento casi total de la piel» (1) con una reducción de al menos dos puntos desde el valor basal; y al menos un porcentaje del 75 % desde el valor basal en la puntuación del EASI 75, ambos en la semana 16. Lebrikizumab en combinación con TCS también alcanzó todos los criterios de valoración secundarios principales frente a placebo en pacientes con DA, incluyendo una mejora de la piel y el alivio del picor, una mejora em la interferencia del picor en el sueño y la calidad de vida del paciente. Los criterios de valoración secundarios principales se midieron mediante el EASI, la escala de valoración numérica (Numerical Rating Scale, NRS) del prurito, la pérdida de sueño debida al prurito y el índice de Calidad de Vida Dermatológica (DLQI).
Los resultados de seguridad del estudio ADhere de 16 semanas controlado con placebo fueron coherentes con el periodo de 16 semanas de los dos estudios de monoterapia del programa de fase III de lebrikizumab para la DA. En los pacientes tratados con lebrikizumab, las reacciones adversas (RAs) más frecuentes fueron conjuntivitis y dolor de cabeza.
En agosto de 2021, Almirall anunció los resultados preliminares de los estudios ADvocate 1 y ADvocate 2, mostrando como lebrikizumab como monoterapia cumplió con los criterios de valoración primarios y secundarios clave, incluido el prurito, la interferencia del prurito en el sueño y la calidad de vida en la semana 16.
«Una vez más, estamos satisfechos con los buenos datos recibidos hasta ahora de lebrikizumab, bien como monoterapia (como se presentó en los estudios ADvocate 1 y 2 el pasado mes de agosto) o combinado con corticosteroides (como se demuestra con los resultados del programa de ensayos clínicos de fase 3 ADhere presentados hoy). Estos resultados respaldan el papel crucial de los inhibidores de la citocina IL-13 en el tratamiento de la DA y representan otro logro clave en nuestro camino por ofrecer avances en el tratamiento de la DA a los pacientes y a los profesionales sanitarios, que buscan nuevas opciones para cubrir las necesidades actuales no cubiertas», declaró el doctor Karl Ziegelbauer, Chief Scientific Officer de Almirall.
Se espera que los resultados completos de ADhere, junto con los datos de dos ensayos de fase 3 en monoterapia, ADvocate 1 y ADvocate 2, se presenten en futuros congresos científicos en 2022. A la espera de que se completen con éxito los ensayos de monoterapia ADvocate 1 y ADvocate 2 en curso, Almirall y Eli Lilly and Company tienen la intención de iniciar el próximo año la presentación de solicitudes reglamentarias en la UE, Estados Unidos y otros países.
«Estos resultados se suman al conjunto de pruebas cada vez mayor de nuestro extenso programa de ensayos clínicos de fase 3. Esperamos seguir colaborando con Almirall para avanzar en nuestros planes de presentación a nivel mundial con la esperanza de que lebrikizumab esté disponible para quienes todavía tienen una necesidad sin cubrir», dijo la doctora Lotus Mallbris, vicepresidenta de Desarrollo Inmunológico de Lilly.
Almirall tiene los derechos de desarrollo y comercialización de lebrikizumab para el tratamiento de indicaciones dermatológicas, incluida la DA, en Europa. Lilly tiene los derechos exclusivos para el desarrollo y la comercialización de lebrikizumab en Estados Unidos y el resto del mundo a excepción de Europa.
Sobre ADhere y el programa de fase 3
ADhere es un estudio de fase III de 16 semanas de duración del tratamiento, aleatorio, doble-ciego, controlado con placebo, y de grupos paralelos, diseñado para evaluar la eficacia y la seguridad de lebrikizumab en combinación con CET en pacientes adultos y adolescentes (edad comprendida entre 12 y menos de 18 años y con un peso de al menos 40 kg) con DA de moderada a grave. En el estudio, los síntomas de la DA de los pacientes no se controlaban de forma adecuada con los CET con o sin inhibidores tópicos de la calcineurina (ITC).
La Agencia de Alimentos y Medicamentos de Estados Unidos (FDA) concedió la designación de vía rápida a lebrikizumab para la DA en diciembre de 2019. El programa de fase 3 de lebrikizumab consta de cinco estudios globales en curso que incluyen dos estudios de monoterapia, el estudio de combinación ADhere de hoy, y ensayos de extensión a largo plazo (ADjoin) y de etiqueta abierta para adolescentes (ADore).
Sobre la dermatitis atópica
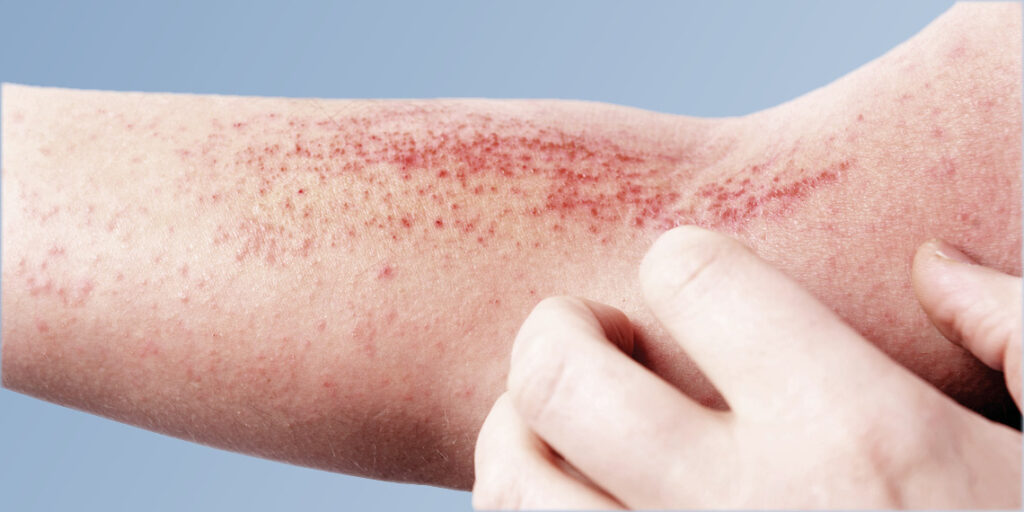
La dermatitis atópica (DA), o eczema atópico, es una enfermedad cutánea crónica y recurrente que se caracteriza por un intenso picor, sequedad de la piel e inflamación que puede presentarse en cualquier parte del cuerpo.7 La DA es una enfermedad heterogénea tanto biológica como clínica, y puede caracterizarse por presentar un aspecto muy variable en el que los brotes se producen de forma impredecible.8
La DA de moderada a grave se caracteriza por un intenso picor, que conduce a un ciclo de picor-rascado que daña aún más la piel.9 Al igual que otras enfermedades inflamatorias crónicas, la DA está mediada por el sistema inmunitario e implica una compleja interacción de células inmunitarias y citoquinas inflamatorias. 7
Sobre Lebrikizumab
Lebrikizumab es un nuevo anticuerpo monoclonal inyectable humanizado diseñado para unirse a IL-13 con una afinidad muy alta, que previene específicamente la formación del complejo heterodímero IL-13Rα1 / IL-4Rα y la señalización subsiguiente, inhibiendo así los efectos biológicos de IL-13 de forma eficiente y específica. IL-13 es un mediador patógeno central que impulsa múltiples aspectos de la fisiopatología de la dermatitis atópica al promover la inflamación de tipo 2 y mediando sus efectos en el tejido, lo que produce disfunción de la barrera cutánea, picazón, engrosamiento de la piel e infección.
Sobre Almirall
Almirall es una compañía biofarmacéutica global enfocada en la salud de la piel. Colaboramos con científicos y profesionales de la salud para abordar las necesidades del paciente a través de la ciencia con el fin de mejorar sus vidas. Nuestro Noble Purpose guía nuestro trabajo: “Transform the patients’ world by helping them realize their hopes and dreams for a healthy life”. Invertimos en productos de dermatología médica diferenciados y pioneros para llevar nuestras soluciones innovadoras a los pacientes que lo necesitan. La compañía, fundada en 1943 y con sede en Barcelona, cotiza en la Bolsa de Valores de España y es miembro del IBEX 35 (teletipo: ALM). A lo largo de sus 78 años de historia, Almirall ha mantenido un fuerte compromiso con las necesidades de los pacientes. Actualmente, Almirall tiene presencia directa en 21 países y acuerdos estratégicos en más de 70, a través de 13 filiales, con aproximadamente 1.800 empleados. Los ingresos totales en 2020 fueron de 814,5 millones de euros.
Para más información, por favor visite www.almirall.es
1 Moyle M, et al. Exp Dermatol. 2019;28(7):756-768.
2 Ultsch M, et al. J Mol Biol. 2013;425(8):1330-1339.
3 Zhu R, et al. Pulm Pharmacol Ther. 2017;46:88-98.
4 Simpson EL, et al. J Am Acad Dermatol. 2018;78(5):863-871.e11.
5 Okragly A, et al. Comparison of the Affinity and in vitro Activity of Lebrikizumab, Tralokinumab, and Cendakimab. Presented at the Inflammatory Skin Disease Summit, New York, November 3-6, 2021.
6 Bieber T. Allergy. 2020;75(1):54-62.
7 Ungar B, et al. J Invest Dermatol. 2017;137(3):603-613.
8 Weidinger S, Novak N. Lancet. 2016;387:1109-1122.
9 Langan SM, et al. Arch Dermatol. 2008;142:1109. 10 Yosipovitch G, et al. Curr Allergy Rep. 2008;8:306-311.