Novedades de la urticaria crónica espontánea
Puntos clave
|
Introducción
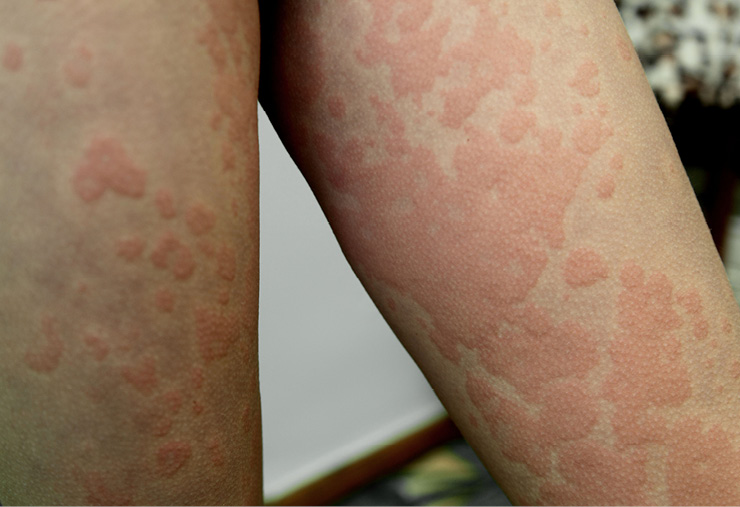
La urticaria crónica espontánea (UCE) es una enfermedad en la que aparecen habones y/o angioedema de forma espontánea durante más de 6 semanas. En la última guía de consenso internacional de la EAACI/GA²LEN/EuroGuiDerm/APAAACI, publicada en 2021, se acepta que la causa puede ser desconocida o conocida, por ejemplo, debida a autoinmunidad6.
En la última década el tratamiento ha avanzado gracias a los antihistamínicos H1 de segunda generación y al fármaco biológico omalizumab, pero todavía quedan muchas preguntas por responder. En este artículo hablaremos de los avances de los últimos años en la UCE, así como de lo que se está investigando y lo que puede deparar el futuro próximo.
Urticaria crónica y COVID-19
En un estudio multicéntrico transversal realizado en agosto de 2020, se envió un cuestionario a médicos que habitualmente tratan la UCE1. La conclusión fue que la pandemia por COVID-19 tuvo un impacto negativo en el seguimiento de los pacientes, pues la mitad de los médicos se estaban dedicando al cuidado de los pacientes con COVID-19, las consultas presenciales se habían reducido en más del 60 % y se estaban usando menos corticoides y ciclosporina. Sin embargo, se mantuvo el uso de antihistamínicos y omalizumab. En este mismo estudió se sugirió que la infección por COVID-19 exacerbaba la UCE1. En otro estudio transversal con un cuestionario dirigido a pacientes, se sugirió que el tratamiento con omalizumab no interfiere en la evolución de la infección2.
Omalizumab
El omalizumab es un anticuerpo monoclonal humanizado de tipo inmunoglobulina G1 (IgG1) que se une a la IgE libre y evita que se una a la región Fc del receptor FcεRI en la superficie de los mastocitos y los basófilos8. Está aprobado para el tratamiento de la UCE.
Los estudios en vida real muestran que omalizumab es eficaz para el control de los síntomas3.
En un metaanálisis de 67 estudios se ha concluido que la remisión completa se alcanzaba en el 72,2 % de los pacientes (IC 95 %: 66,1 %-78,3 %)3, un porcentaje mayor que el observado en los ensayos clínicos (43 %)8.
Sin embargo, en otra revisión sistemática puntualizan que la evidencia con la que omalizumab reduce los signos y síntomas de la UCE es moderada, debido a la imprecisión de los estudios y a un posible sesgo por patrocinio9.
Se recomienda continuar con el tratamiento durante al menos 6 meses antes de decidir que no hay respuesta8; la experiencia en ensayos clínicos durante más de 6 meses en esta indicación es limitada 10. La falta de respuesta a omalizumab está directamente relacionadacon bajos niveles de IgE total en sangre11.
Una vez que la enfermedad está controlada, se debe aumentar el intervalo entre dosis una semana de cada vez y cuando el paciente tolere un periodo de 8 semanas sin tratamiento, se puede suspender el omalizumab 8.
Nuevos tratamientos para la urticaria crónica espontánea
Hay múltiples ensayos clínicos en marcha para el tratamiento de la UCE con fármacos biológicos4.
En la Tabla 1 se detallan algunos de los estudios que se están llevando a cabo o se han realizado recientemente para encontrar nuevos principios activos para el tratamiento de la UCE.
Tabla 1. Nuevos fármacos en estudio para el tratamiento de la urticaria crónica espontánea
| Objetivo | Fármaco | Descripción y localización | Identificador ClinicalTrials.gov |
| IgE | Ligelizumab | ECA multicéntricos de fases 2 y 3 | NCT03437278
NCT03580356 NCT03580369 |
| UB-221 | Fase 1, escalada de dosis. Taiwán | NCT03632291 | |
| Siglec-8 | AK002, anti-Siglec-8 | EC abierto de fase 2a
EE. UU. y Alemania |
NCT03436797 |
| CRTH2 | AZD1981, anti-CRTH2 | ECA de fase 2a
EE. UU. |
NCT02031679 |
| Linfocitos T | Abatacept | Fases 1-2, EC abierto. EE. UU. | NCT00886795 |
| Receptor α de IL-5 | Benralizumab12 | EC abierto, simple ciego
EE. UU. |
NCT03183024 |
| IL-5 | Mepolizumab | EC abierto exploratorio, con un solo grupo. EE. UU. | NCT03494881 |
| IL-4/13 | Dupilumab | ECA de fase 2a
Alemania, multicéntrico |
NCT03749135 |
| Tirosina-cinasa del bazo | GSK2646264 crema tópica | ECA internacional | NCT02424799 |
| Tirosina-cinasa de Bruton | Lou064 | ECA de fase 2a. Multicéntrico | NCT03926611 |
| Fenebrutinib | Fase 2. Internacional | NCT03137069
NCT03693625 |
CRTH2: chemoattractant receptorehomologous molecule expressed on T helper type 2; EC: ensayo clínico; ECA: ensayo clínico aleatorizado.
Fuente: adaptado de Kolkhir et al.4
El ligelizumab es un anticuerpo monoclonal IgG1 que se une al dominio Cε3 de la IgE con más afinidad que el omalizumab13. En un ensayo de fase 2b de búsqueda de dosis se alcanzó el control completo de los síntomas en el 40 % de los pacientes, sin que surgiesen complicaciones importantes14.
El anti-Siglec-8 (AK002) es un anticuerpo monoclonal humanizado de tipo IgG1 contra Siglec-8, una proteína expresada en la superficie de eosinófilos y mastocitos15. Un estudio de fase 2a abierto ha arrojado resultados prometedores en pacientes resistentes al tratamiento con antihistamínicos13.
El CRTH2 es un receptor acoplado a proteínas G presente en la superficie de los linfocitos Th2, eosinófilos y basófilos, cuya activación se cree que causa la activación y quimiotaxis de basófilos y eosinófilos13. En un ensayo clínico aleatorizado de fase 2 comparativo con placebo, el AZD1981 (un antagonista del CRTH2) disminuyó la actividad de la UCE, sin que se encontrasen efectos adversos importantes16.
La tirosina-cinasa de Bruton actúa en la vía de activación de los mastocitos mediante el receptor FcεRI y en la producción de autoanticuerpos en la UCE. El fenebrutinib es un inhibidor reversible, potente y muy selectivo de esta cinasa. En un ensayo de fase 2 comparativo con placebo, con enmascaramiento doble, la actividad de la UCE disminuyó de forma dosis-dependiente, también en los pacientes con autoinmunidad de tipo II17.
Identificación de biomarcadores de la actividad de la urticaria
Entre las causas conocidas de la UCE se encuentran las reacciones de hipersensibilidad autoinmune, que pueden ser de tipo I (autoalergia) o de tipo IIb.
Se han identificado dos grupos de señales autoinmunes que activan la desgranulación de los mastocitos, que además han permitido la determinación de dos causas conocidas de urticaria crónica. Según el tipo de autoinmunidad, la UCE se clasifica como6,7:
- Tipo I o autoalergia: está mediada por IgE. La evaluación de los autoanticuerpos IgE es un tema por dilucidar. La tiroperoxidasa (TPO) es un autoalérgeno común y relevante en la UCE7. También puede haber IgE contra la tiroglobulina, el factor tisular y la interleucina-24, y en este último caso se ha demostrado que mastocitos cargados con esta IgE son activados al exponerse a la IL-247,18. Se han encontrado autoanticuerpos contra más de 200 proteínas en pacientes con UCE, cuyo significado patogénico todavía se desconoce18.
- Tipo IIb: presenta autoanticuerpos de tipo IgG que activan los receptores de los mastocitos (IgG-anti-FcεRI). Son marcadores serológicos de este grupo la elevación de la proteína C reactiva (PCR), el menor recuento de eosinófilos y basófilos en sangre periférica, la menor cantidad de IgE total, y la elevación de la IgG anti-TPO.
El cociente de anticuerpos anti-TPO sobre la IgE total es el mejor marcador indirecto para el diagnóstico de la UCE autoinmune de tipo IIb6,7.
El tratamiento con omalizumab o ligelizumab (ambos anti-IgE) genera mejores resultados en la UCE autoalérgica que en la de tipo IIb5,7. Los marcadores que sugieren autoinmunidad mediada por IgG (prueba cutánea del suero autólogo, IgE total baja) parecen identificar a los pacientes con menor probabilidad de responder a omalizumab, pero con más probabilidad de responder a ciclosporina5.
Todavía no se dispone de un biomarcador para la UCE, pues la mayoría no tiene la suficiente especificidad5.
Como biomarcadores de actividad y gravedad se postulan la basopenia y la activación de la cascada de la coagulación19, pero la información es insuficiente5. Se cree que la basopenia en sangre periférica puede indicar mayor reclutamiento de basófilos en la piel y mayor actividad de la enfermedad13,20.
En cuanto a los marcadores histológicos, su importancia de radica sobre todo en la identificación de posibles dianas para futuros tratamientos. Uno de los más prometedores es el MRGPRX2 (Mas-Related G Protein-Coupled Receptor X2)4, un receptor acoplado a proteínas G que se encuentra aumentado en los mastocitos de los pacientes con UCE. Responde al estímulo de numerosos péptidos y fármacos en desarrollo de forma independiente al receptor de la IgE4,13.
Otras posibles dianas son el receptor de histamina H4, C5a y su receptor CD88; receptores inhibidores de los mastocitos (además de Siglec-8); citocinas inductoras de inmunidad de tipo Th2 (IL-33, IL-25 y TSLP); y el factor de células madre4.
También se ha postulado la proteína de traslación controlada del tumor (TCTP, por sus siglas en inglés) como activadora de la desgranulación de mastocitos y basófilos15.
Perfil de seguridad de los tratamientos disponibles y farmacovigilancia a largo plazo
La indicación de dar antihistamínicos H1 de segunda generación en dosis de hasta cuatro veces por encima de la habitual está recogida en las guías clínicas6, pero se encuentra fuera de ficha técnica.
En una revisión sobre la potencial cardiotoxicidad de estos fármacos (por alargamiento del intervalo QT), se vio que tienen un excelente perfil de seguridad y no hay evidencia de cardiotoxicidad incluso tras aumentar su dosis habitual 4 veces21.
Sin embargo, los datos procedían de estudios in vitro o voluntarios sanos y, por tanto, se debería ser cuidadoso y evitar dosis altas en ancianos y pacientes con enfermedades cardiovasculares, o en presencia de hipopotasemia o hipomagnesemia. En otra revisión sistemática, la baja calidad y heterogeneidad de los artículos hizo imposible alcanzar conclusiones sólidas, pero los efectos adversos más frecuentes fueron cefalea y mareo22.
Respecto al omalizumab, un metanálisis investigó la posible relación con el desarrollo o progresión de cáncer cutáneo: no se encontraron aumentos estadísticamente significativos, pero la evidencia fue insuficiente23.
Otras áreas novedosas o actualmente en estudio
Algunos otros temas que presentan novedades o que se están investigando son los que se presentan a continuación.
Administración continua o a demanda de antihistamínicos H1 y su efecto en la duración y la gravedad de la urticaria. En la actualización de 2021 de la guía internacional de la urticaria se sugiere que los antihistamínicos se administren de forma pautada y no a demanda6.
Epidemiología global, en adultos y en niños. En un metanálisis de 2019 se vio que la prevalencia varía entre países: en Asia la UCE afecta al 1,4 % de la población, mientras que en Europa y Norteamérica al 0,5 %. Afecta ligeramente más a las mujeres, aunque solamente en mayores de 15 años24. La prevalencia ha aumentado de 2 a 10 veces durante la última década25.
Consecuencias socioeconómicas. Los costes directos son de unos 900 $ (de paridad de poder adquisitivo) en Italia y 2400 $ en Francia, y los costes indirectos de 6550 $ en Francia y 15 550 $ en Alemania, principalmente debido a la pérdida de productividad en el trabajo. En EE. UU., los pacientes con UCE acuden más a los servicios de salud. Se ha visto que la UCE afecta al sueño, la vida familiar y de pareja y la vida sexual; además, aumenta el absentismo escolar y genera frustración por la impredecibilidad de los brotes. Un estudio en Nueva Zelanda demostró que el omalizumab es coste-efectivo por su alta eficacia y seguridad, con menor consumo de recursos y costes indirectos25.
Rol de la coagulación y estudios multicéntricos sobre el posible efecto de los anticoagulantes en la UCE. Se han revisado los mecanismos por los que los sistemas de la coagulación pueden estar implicados en la UCE, pero todavía se precisan nuevos estudios que evalúen el efecto de los medicamentos que actúan a este nivel26. Un metanálisis sobre el ácido tranexámico arrojó resultados inconsistentes, y actualmente hay un ensayo clínico en marcha comparando la eficacia y seguridad de levocetiricina combinada o no con ácido tranexámico (NCT03789422)4.
Impacto de las enfermedades psiquiátricas y psicosomáticas asociadas. El estrés actúa como un factor facilitador o predisponente de la UCE. Se cree que lleva a un aumento de la inflamación y a la alteración de los subtipos de linfocitos T, con reducción de los linfocitos T reguladores y control inadecuado de los linfocitos B. Además, los neuropéptidos que se liberan con el estrés pueden activar los mastocitos por la vía del MRGPRX218.
Otros. Algunos temas que precisan más estudios son desarrollar de pruebas in vitro comerciales para detectar autoanticuerpos contra Ig-E o FcɛRI; avanzar en el conocimiento sobre los mecanismos patogénicos de la urticaria resistente a antihistamínicos; comparar mediante ensayos la eficacia de los diferentes antihistamínicos H1 en dosis altas; o conocer qué papel pueden tener los antihistamínicos H2, el montelukast, las sulfonas, el metotrexato o la azatioprina en el tratamiento de esta patología6.
Conclusiones
Aunque los antihistamínicos H1 de segunda generación y el omalizumab han supuesto un importante avance en el tratamiento de la UCE, algunos pacientes continúan sin un buen control de la enfermedad. Todavía se desconoce qué biomarcadores específicos pueden indicar si un paciente responderá al tratamiento o no; su descubrimiento puede marcar el camino para el desarrollo de nuevos fármacos. Además, parece que la prevalencia de la enfermedad está en aumento y se necesitan más estudios sobre el impacto de la enfermedad en la sociedad.
Bibliografía
- Kocatürk E, Salman A, Cherrez-Ojeda I, Criado PR, Peter J, Comert-Ozer E, et al. The global impact of the COVID-19 pandemic on the management and course of chronic urticaria. Allergy. 2021;76(3):816-30.
- Bostan E, Zaid F, Karaduman A, Dogan S, Gulseren D, Yalici-Armagan B, et al. The effect of COVID-19 on patients with chronic spontaneous urticaria treated with omalizumab and antihistamines: A cross-sectional, comparative study. Clin Cosmet Investig Dermatol. 2021;20(11):3369-75.
- Tharp MD, Bernstein JA, Kavati A, Ortiz B, MacDonald K, Denhaerynck K, et al. Benefits and Harms of Omalizumab Treatment in Adolescent and Adult Patients with Chronic Idiopathic (Spontaneous) Urticaria: A Meta-analysis of “real-world” Evidence. JAMA Dermatol. 2019;155(1):29-38.
- Kolkhir P, Altrichter S, Munoz M, Hawro T, Maurer M. New treatments for chronic urticaria. Ann Allergy Asthma Immunol. 2020;124(1):2-12.
- Asero R, Cugno M. Biomarkers of chronic spontaneous urticaria and their clinical implications. Expert Rev Clin Immunol. 2021;17(3):247-54.
- Zuberbier T, Abdul Latiff AH, Abuzakouk M, Aquilina S, Asero R, Baker D, et al. The international EAACI/GA2LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2021;39.
- Maurer M, Eyerich K, Eyerich S, Ferrer M, Gutermuth J, Hartmann K, et al. Urticaria: Collegium Internationale Allergologicum (CIA) Update 2020. Int Arch Allergy Immunol. 2020;181(5):321-33.
- Khan DA, Kocatürk E, Bauer A, Aygören-Pürsün E. What’s New in the Treatment of Urticaria and Angioedema. J Allergy Clin Immunol Pract. 2021;9(6):2170–84.
- Agache I, Rocha C, Pereira A, Song Y, Alonso-Coello P, Solà I, et al. Efficacy and safety of treatment with omalizumab for chronic spontaneous urticaria: A systematic review for the EAACI Biologicals Guidelines. 2021;76(1):59-70.
- Agencia española de medicamentos y productos sanitarios. Xolair 75 mg polvo y disolvente para solución inyectable. Ficha técnica o resumen de las características del producto. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/05319008/FT_05319008.pdf
- Fok JS, Kolkhir P, Church MK, Maurer M. Predictors of treatment response in chronic spontaneous urticaria. Allergy. 2021;76(10):2965-81.
- Bernstein JA, Singh U, Rao MB, Berendts K, Zhang X, Mutasim D. Treatment of chronic spontaneous urticaria with benralizumab: Report of primary endpoint per-protocol analysis and exploratory endpoints. Allergy. 2021;76(4):1277-80.
- Johal KJ, Saini SS. Current and emerging treatments for chronic spontaneous urticaria. Ann Allergy Asthma Immunol. 2020;125(4):380-7.
- Maurer M, Giménez-Arnau AM, Sussman G, Metz M, Baker DR, Bauer A, et al. Ligelizumab for Chronic Spontaneous Urticaria. NEJM. 2019;381(14):1321-32.
- Sánchez-Borges M, Díaz SG, Ortega-Martell JA, Rojo MI, Ansotegui IJ. Current and Potential Biologic Drugs for the Treatment of Chronic Urticaria. Immunol Allergy Clin North Am. 2020;40(4):609-23.
- Tyrell E, Chichester K, Meghan P. Effects of an oral CRTh2 antagonist (AZD1981) on eosinophil activity and symptoms in chronic spontaneous urticaria. Int Arch Allergy Immunol. 2019;179(4):21-30.
- Metz M, Sussman G, Gagnon R, Staubach P, Tanus T, Yang WH, et al. Fenebrutinib in H1 antihistamine-refractory chronic spontaneous urticaria: a randomized phase 2 trial. Nat Med. 2021;27(11):1961-9.
- Bansal CJ, Bansal AS. Stress, pseudoallergens, autoimmunity, infection and inflammation in chronic spontaneous urticaria. Allergy Asthma Clin Immunol. 2019;15(1):1-11.
- Mostmans Y, de Smedt K, Richert B, Elieh Ali Komi D, Maurer M, Michel O. Markers for the involvement of endothelial cells and the coagulation system in chronic urticaria: A systematic review. Allergy. 2021;76(10):2998-3016.
- Huang AH, Chichester KL, Saini SS. Association of basophil parameters with disease severity and duration in chronic spontaneous urticaria (CSU). J Allergy Clin Immunol Pract. 2020;8(2):793-795.e6.
- Cataldi M, Maurer M, Taglialatela M, Church MK. Cardiac safety of second-generation H1-antihistamines when updosed in chronic spontaneous urticaria. Clin Exp Allergy. 2019;49(12):1615-23.
- Iriarte Sotés P, Armisén M, Usero-Bárcena T, Rodriguez Fernández A, Otero Rivas MM, Gonzalez MT, et al. Efficacy and safety of up-dosing antihistamines in chronic spontaneous urticaria: A systematic review of the literature. J Investig Allergol Clin Immunol. 2021;31(4):282-91.
- Johnston A, Smith C, Zheng C, Aaron SD, Kelly SE, Skidmore B, et al. Influence of prolonged treatment with omalizumab on the development of solid epithelial cancer in patients with atopic asthma and chronic idiopathic urticaria: A systematic review and meta-analysis. Clin Exp Allergy. 2019;49(10):1291-305.
- Fricke J, Ávila G, Keller T, Weller K, Lau S, Maurer M, et al. Prevalence of chronic urticaria in children and adults across the globe: Systematic review with meta-analysis. Allergy. 2020;75(2):423-32.
- Gonçalo M, Gimenéz-Arnau A, Al-Ahmad M, Ben-Shoshan M, Bernstein JA, Ensina LF, et al. The global burden of chronic urticaria for the patient and society. Br J Dermatol. 2021;184(2):226-36.
- Yanase Y, Takahagi S, Ozawa K, Hide M. The role of coagulation and complement factors for mast cell activation in the pathogenesis of chronic spontaneous urticaria. Cells. 2021;10(7).