Patología
¿Qué es la queratosis actínica? ¿Es frecuente?
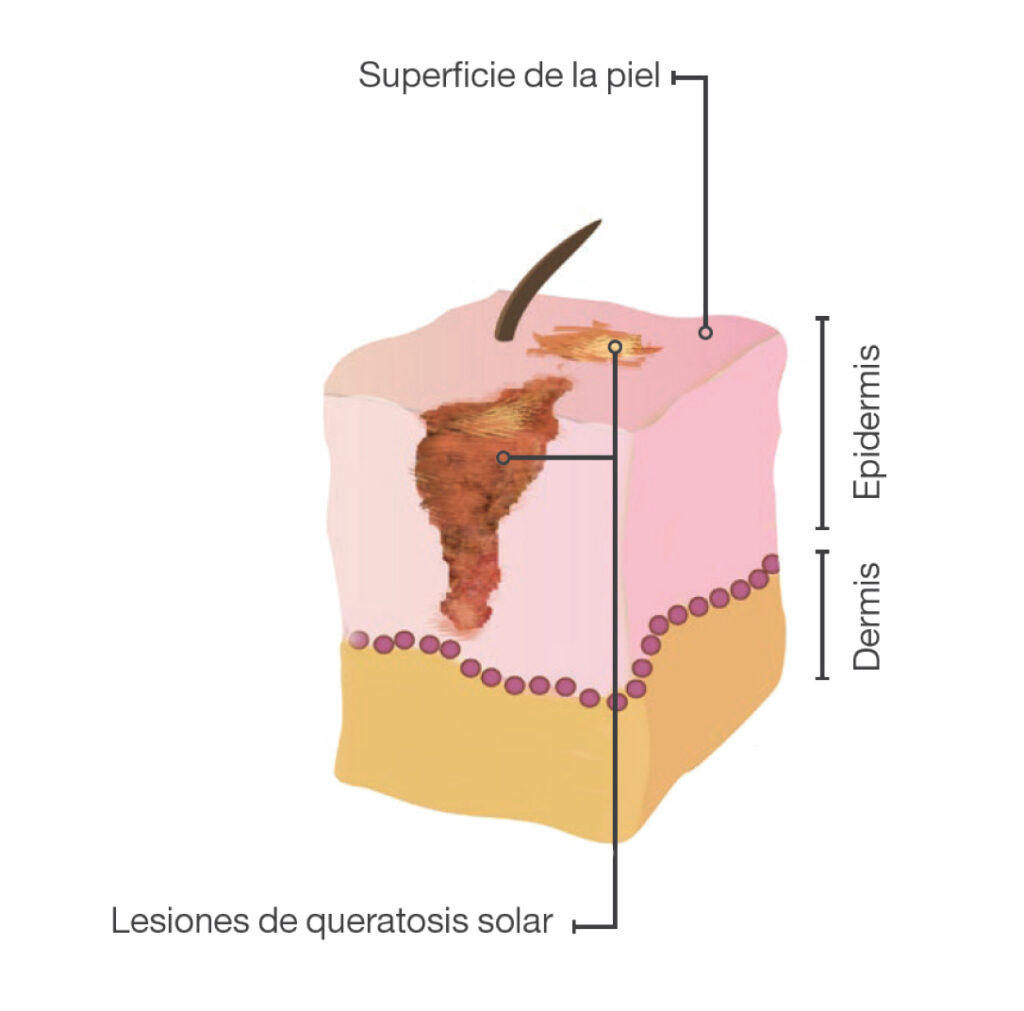
La queratosis actínica (QA), también conocida como queratosis solar, es una lesión dérmica que aparece en personas adultas expuestas de forma crónica a la radiación ultravioleta (UV) y producida por la proliferación de queratinocitos epidérmicos atípicos (Figura 1). Las QA se consideran, por lo general, lesiones premalignas de carcinoma de células escamosas (CCE), aunque con un riesgo de malignidad bajo y con cierto potencial de regresión espontánea1.
Figura 1. Queratosis actínica
Es difícil conocer con exactitud la incidencia y prevalencia exactas de la QA, y es probable que los datos de los que disponemos al respecto estén subestimados2. No obstante, la población afectada por al menos una lesión es mayor en los países más cercanos al ecuador, y el riesgo de desarrollar QA aumenta a medida que avanza la edad3. En personas de piel clara mayores de 60 años, la prevalencia puede alcanzar el 60 %4. En Europa, varía entre el 1 % y el 38 %, según los estudios; esta variación puede deberse a diferencias en los factores demográficos, la radiación solar acumulada y el estilo de vida5.
En España, la QA constituye uno de los principales motivos de consulta dermatológicos, ya que se estima que aproximadamente una cuarta parte de la población ambulatoria a partir de los 45 años padece QA6.
La prevalencia es mayor en hombres que en mujeres5,6,7 y se ha observado que las personas con piel clara son 6 veces más propensas al desarrollo de estas lesiones que las personas con piel oscura8. Además, ciertas enfermedades genéticas como el albinismo y el xeroderma pigmentoso pueden precipitar el desarrollo de QA a edades más tempranas9,10.
¿Cuáles son las causas y factores de riesgo?
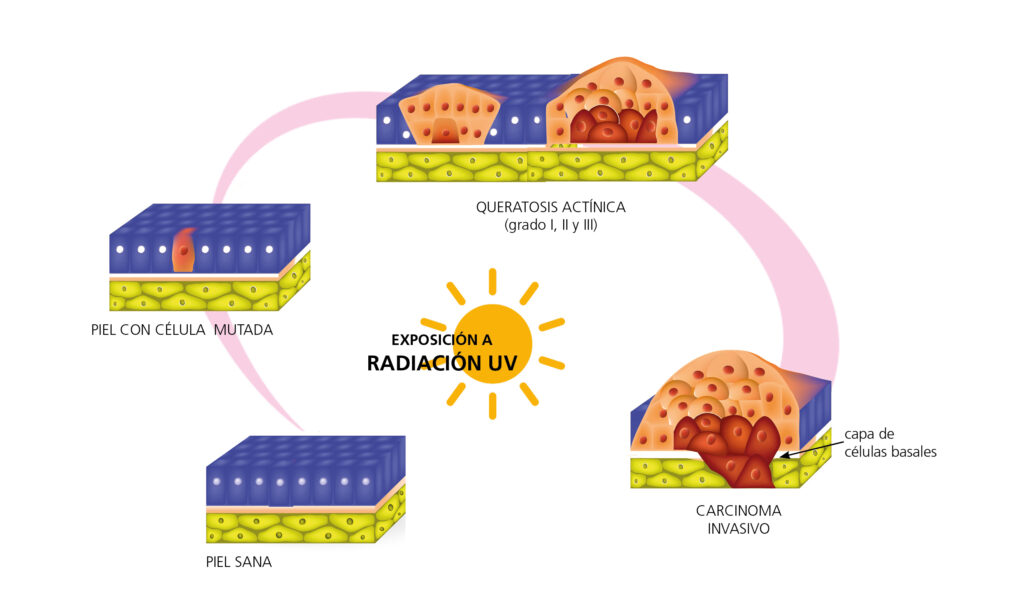
Un factor etiológico clave para el desarrollo de QA es la exposición crónica a los rayos UV, principalmente a UVB (290 a 320 nanómetros). Esta exposición produce daños en el ADN de los queratinocitos. Estos daños se han asociado a la carcinogénesis dérmica11,12 a través de mutaciones en el gen supresor p5313,14 (Figura 2).
Figura 2. Efecto de la exposición de la piel a la radiación ultravioleta, desde la mutación del queratinocito hasta un carcinoma invasivo
Por este motivo, las personas con historia de exposición prolongada al sol o que trabajan al aire libre15,16, así como aquellas que tienen antecedentes personales de 6 o más quemaduras solares a lo largo de su vida, tienen un riesgo mayor de sufrir QA17. La presencia de una sola lesión de QA es marcador de una exposición solar excesiva y de la aparición de futuras lesiones1.
Este riesgo también puede aumentar en personas con antecedentes de quemaduras solares durante la infancia (incluso con un único episodio)18, de ahí la importancia del uso de protectores solares como medida preventiva del desarrollo de QA19.
Los principales factores de riesgo de QA son la exposición crónica al sol, la piel clara, la edad avanzada y el sexo masculino15-17,20.
Además, en el desarrollo de QA también pueden estar implicados otros factores de riesgo. Los vemos a continuación:
- Fenotipo: el color claro de la piel constituye un factor de riesgo de QA, ya que la melanina epidérmica absorbe la radiación UV y protege a los queratinocitos contra el daño de la luz UV. De hecho, la mayoría de este tipo de lesiones se observan en personas con piel clara16,18 y otras características adicionales asociadas a un mayor riesgo de sufrir QA, como pecas, cabello de color claro, propensión a sufrir quemaduras solares con facilidad y dificultad para broncearse21.
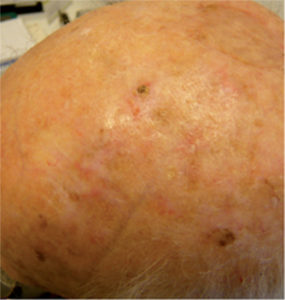
- La ausencia de cabello (Figura 3) es otro factor de riesgo para el desarrollo de QA, ya que este tipo de lesiones se observan con frecuencia en hombres con calvicie. Este factor es especialmente importante en las personas con formas más graves de calvicie, en las que el riesgo de tener 10 o más lesiones de QA puede aumentar hasta 7 veces en comparación con los hombres con formas de calvicie menos graves o sin ella10.
- Género. Como hemos visto, los hombres son más propensos que las mujeres a desarrollar QA5,6,7.
- Edad. La prevalencia de QA aumenta con la edad10,22.
- Ubicación geográfica. La QA es menos frecuente en Estados Unidos y el norte de Europa, donde la exposición al sol suele ser menor8. En España, la prevalencia en personas caucásicas mayores de 45 años es mayor en la región mediterránea (31,4 %) y en el sur (28,1 %), y menor en el norte (27,5 %) y la región central (24,9 %)6.
- Inmunodepresión y trasplante de órgano sólido. Los pacientes inmunosuprimidos tienen más riesgo de cáncer de piel1. Los enfermos receptores de trasplante de órgano sólido —que requieren una inmunosupresión mantenida— tienen mayor riesgo de presentar QA, que a menudo se manifiestan con una clínica atípica. Suelen ser lesiones múltiples, con un riesgo mayor y una evolución más rápida a CCE invasivo que la población inmunocompetente23. El riesgo también se multiplica más de 5 veces en pacientes con leucemia linfática crónica24.
- Otros factores de riesgo incluyen la exposición a rayos X, radioisótopos y arsénico. También el virus del papiloma humano (VPH) se ha asociado a un aumento del riesgo, especialmente en pacientes inmunodeprimidos y trasplantados25,26, así como en pacientes con epidermodisplasia verruciforme27. No obstante, el VPH también se puede detectar en la piel normal28, por lo que se desconoce la relación etiológica entre el VPH y la QA. El riesgo de QA también es mayor en personas con antecedentes personales de QA o cáncer de piel, así como en personas con trastornos genéticos como el xeroderma pigmentoso, el síndrome de Bloom y el síndrome de Rothmund-Thompson, debido a que en estos trastornos existe una alteración de la reparación del ADN tras la exposición a la radiación UV29.
El riesgo relativo de desarrollar QA en las personas trasplantadas se multiplica por 250 en relación con las personas inmunocompetentes23.
Figura 3. Queratosis actínica en el cuero cabelludo de un hombre con alopecia
Fuente: Almirall S.A.
¿Cuáles son sus manifestaciones clínicas?
La QA se manifiesta con frecuencia en adultos de mediana edad y piel clara en forma de máculas, placas o pápulas eritematosas y escamosas, solitarias o múltiples, en zonas expuestas al sol (como el cuero cabelludo, la cara, el dorso de las manos o antebrazos, la zona lateral del cuello y zonas distales de las extremidades superiores o inferiores).
La apariencia y color de estas lesiones es variable: pueden ser del mismo color de la piel, amarillentas o eritematosas; la forma puede ser irregular y mal definida o, en algunos subtipos, bien definida. Así, desde el punto de vista clínico, podemos establecer la siguiente clasificación en las formas de presentación de la QA30,31:
- Común. Una o múltiples máculas o pápulas escamosas ásperas, de 1 a 5 mm de diámetro, amarillentas o eritematosas, mal definidas y de forma irregular.
- Hiperqueratósica. Una o múltiples máculas o pápulas escamosas de 1 a 5 mm de diámetro y del color de la piel, amarillentas o eritematosas, de superficie hiperqueratósica, mal definidas, de forma irregular.
- Pigmentada. Mácula escamosa o placa marrón bien definida similar al léntigo solar, y que a veces se asemeja a la queratosis seborreica, al nevus melanocítico o al melanoma maligno temprano32.
- Verrucosa. Pápula del color de la piel, papilomatosa, elevada, con aspecto verrucoso.
- Atrófica. Placas con escamas muy suaves sobre una piel brillante muy delgada.
- Liquen plano (liquenoide). Pápula violácea, bien definida, con líneas blancas finas en la superficie.
- Queilitis actínica. Aspereza roja escamosa con induración, fisuras y ulceración del labio inferior a las comisuras33.
- Cuerno cutáneo: protuberancia hipertrófica con forma cónica que crece desde la superficie de la piel34.
Además de estas manifestaciones, con frecuencia la piel que rodea a la QA muestra signos de daño solar: es el llamado campo de cancerización. Aunque no existe un consenso para su definición, habitualmente la piel está atrófica y ha adquirido una coloración pálido-amarillenta, con despigmentación e hiperpigmentación irregular, telangiectasias dispersas y textura de papel de lija35. En este campo existen células alteradas genéticamente con riesgo de transformación maligna36.
La QA suele ser asintomática, aunque algunos pacientes refieren notar un aumento de sensibilidad, sensación pruriginosa en la zona afectada o, incluso, sangrado si hay rascado de la lesión. Clínicamente, las lesiones se pueden clasificar en tres niveles según su gravedad (Tabla 1)1,36.
Tabla 1. Niveles de gravedad de la queratosis actínica1,36
| Gravedad | Características |
| Grado I | Leve; marcas rosadas o grises con escamas leves o ásperas al tacto |
| Grado II | Moderado; hiperqueratosis más gruesa y fácilmente detectable |
| Grado III | Grave; hiperqueratosis marcada |
| Campo de cancerización | Área de piel con daño actínico que puede rodear a cada QA y que muestra las mismas alteraciones genéticas que ella. |
QA: Queratosis actínica
Recientemente se ha desarrollado el índice AKASI, una nueva herramienta que permite cuantificar la gravedad de las QA en la cabeza. Tiene en cuenta qué área de la cabeza está afectada, la extensión del campo de cancerización (en porcentaje), y la distribución, eritema y grosor de las QA37.
Desde un punto de vista citológico, las células de las QA son indistinguibles de las del CCE y, desde el punto de vista de la biología molecular, se parecen mucho. Por eso, hay quienes consideran las QA carcinomas in situ, con un bajo potencial de evolucionar a carcinoma invasivo36.
Diagnóstico
¿Cómo detectar la QA?
Una buena estrategia para detectar las lesiones de queratosis actínica en la consulta de atención primaria es examinar las áreas expuestas al sol (cabeza, cuello y dorso de las manos) aunque el paciente acuda por otro motivo1.
En los sistemas sanitarios en los que el médico de atención primaria es el primer contacto con el paciente, podemos detectar lesiones de QA de forma adecuada simplemente con la realización de una exploración dérmica oportunista de 5 minutos de duración, dirigida especialmente a las superficies expuestas al sol (cabeza, cuello y el dorso de las manos)1.
Esta exploración es fundamental en pacientes de alto riesgo (hombres de piel clara y mediana edad y mayores, expuestos de forma crónica al sol y que viven en latitudes más bajas, así como pacientes con albinismo, xeroderma pigmentoso e inmunodeprimidos)30,36.
Para ayudar a recordar las características de estas lesiones y tenerlas presentes durante la exploración física, se ha propuesto la regla de las 5R+R. Las lesiones típicas de la QA son Rojizas, áspeRas, Recurrentes, en la Región cefálica, se relacionan con la Radiación y se dan en pacientes de Riesgo38.
Además, esta primera detección puede combinarse con la prevención y el asesoramiento del paciente para su autocuidado.
¿Cómo se diagnostica?
La gran mayoría de las queratosis actínicas pueden diagnosticarse de forma clínica y tratarse en atención primaria1.
El diagnóstico de QA puede realizarse en atención primaria o especializada, bien como parte de una exploración general de la piel o bien en el contexto de la valoración del daño solar, de lesiones focales queratósicas o de cáncer de piel. En los casos en los que se detecte carácter maligno e invasivo de la lesión, la atención del paciente debe compartirse con un miembro de un equipo multidisciplinario de cáncer de piel1.
El diagnóstico de QA suele ser clínico1,36, de forma que para realizarlo suele ser suficiente una historia clínica característica y la exploración física. Así, una historia clínica compatible con una lesión típica en un hombre de piel clara, mayor de 40 años, que ha pasado mucho tiempo al aire libre desde la infancia sin el uso de protección solar y que cuenta además otros factores de riesgo es determinante para el diagnóstico de QA.
Ciertos signos de la exploración física, como la presencia de máculas o placas pequeñas (1 a 5 mm), del color de la piel, amarillentas o eritematosas, únicas o múltiples, mal definidas y en áreas expuestas al sol (especialmente la frente, cuero cabelludo, orejas, labio inferior y dorso de las manos y antebrazos) complementan el diagnóstico1,36.
Pruebas complementarias
La dermatoscopia se recomienda cuando encontramos signos atípicos para QA durante la exploración clínica.
Se han descrito tres patrones dermatoscópicos de QA no pigmentada39:
- Seudorretículo rojizo con escamas blancas aisladas.
- Patrón en fresa, con eritema de fondo.
- Agrandamiento del folículo piloso, tapado con un tapón queratósico, con fondo blanco-amarillento descamativo.
Aunque en la práctica clínica, distinguir entre lesiones pigmentadas de QA y lentigo maligno puede ser todo un reto, en la dermatoscopia las primeras suelen aparecer como puntos de color gris pizarra a marrón alrededor de los orificios foliculares y como estructuras anulares-granulares y romboidales40. Ciertas características, como la presencia de pigmentación intensa, líneas romboidales grises y la pérdida de folículos identificables, sugieren que puede tratarse de lentigo maligno. No obstante, en estos casos el estudio histopatológico de las lesiones sigue siendo la prueba diagnóstica estándar.
En los casos en los que la exploración clínica y los resultados de la dermatoscopia no son típicos de QA y existe sospecha de malignidad (Cuadro 1), también puede estar indicada una biopsia de la lesión y su estudio histopatológico1,41. Desde el punto de vista histológico podemos diferenciar 5 tipos de QA:
- hipertrófica
- atrófica
- bowenoide (esta categoría es controvertida)
- acantolítica
- pigmentada42.
De esta forma, la biopsia ayuda a descartar otros diagnósticos diferenciales, como los recogidos en la Tabla 2.
Cuadro 1. Indicaciones de la biopsia36
Se recomienda biopsia y estudio histológico en los siguientes casos:
|
QA: queratosis actínica; CCE: carcinoma de células escamosas
Tabla 2. Diagnóstico diferencial de la queratosis actínica42
| Carcinoma de células escamosas in situ (enfermedad de Bowen)* |
| Carcinoma de células escamosas invasivo |
| Queratoacantoma |
| Carcinoma de células basales |
| Queratosis seborreica*^ |
| Lupus eritematoso (discoide localizado, hipertrófico y cutáneo subagudo) |
| Psoriasis |
| Poroqueratosis actínica superficial diseminada |
| Acantoma de células grandes |
| Lentigo solar, lentigo maligno y melanoma in situ^ |
| Verruga* |
| Liquen plano |
* Principalmente para las formas de queratosis actínica hipertróficas o con cuerno cutáneo
^Principalmente para las formas de queratosis actínica pigmentadas
¿Cuáles son los criterios de derivación del paciente con QA?
La mayoría de las QA pueden diagnosticarse y tratarse en atención primaria1,44, aunque existen una serie de situaciones en las que se recomienda la derivación del paciente a atención especializada. Estas situaciones son las siguientes1:
- Lesión/es de QA que no responde/n a los tratamientos habituales;
- Lesiones de QA múltiples o recurrentes de difícil manejo;
- QA que aparecen en pacientes inmunodeprimidos a largo plazo;
- Dudas diagnósticas de que la lesión pueda ser un CCE, por la presencia de síntomas como sangrado, dolor o engrosamiento al palpar la lesión entre el dedo y el pulgar.
Un estudio observacional español reciente ha demostrado que la QA se encuentra infradiagnosticada en atención primaria, y que en la mayoría de las ocasiones es el dermatólogo quien informa al paciente de que padece esta enfermedad45.
La Tabla 3 muestra los pacientes de alto riesgo de CEE y los signos de alerta para derivar a atención especializada.
Tabla 3. Criterios de derivación de atención primaria a dermatología
| Pacientes de alto riesgo | Signos de alerta |
|
|
| Si el paciente no es de alto riesgo o no presenta signos de alerta, valorar tratar en atención primaria. | |
| Si el paciente es de alto riesgo o tiene signos de alerta, ¿tiene antecedentes o signos de carcinoma epidermoide? | |
| Sí | No |
| Derivar al dermatólogo de forma prioritaria | Valorar derivar al dermatólogo |
Fuente: Adaptado de NHS46
Otro criterio a tener en cuenta a la hora de derivar es la localización concreta de algunas lesiones. Las de la zona periocular y del párpado tienen la dificultad de tratar sin dañar el ojo ni la función del párpado, y las de las orejas requieren biopsia con más frecuencia. La queilitis actínica (en el labio) también puede requerir tratamiento por parte del especialista.
Las lesiones de estas localizaciones metastatizan con más frecuencia23,47.
Tratamiento
¿Cuál es el tratamiento de la QA?
El tratamiento de las QA persigue eliminar las lesiones clínicas para evitar que evolucionen a un CCE, tratar el campo de cancerización para evitar que se sigan desarrollando nuevas QA, y reducir el número de recaídas29. Otro aspecto a tener en cuenta es obtener el mejor resultado cosmético posible.
En general, las lesiones de QA pueden erradicarse con seguridad y eficacia. Es cierto que la tasa de malignización es baja, pero existe, y aunque existe un potencial de regresión, este es bajo y las recidivas frecuentes. Por tanto, aunque algunos expertos1 consideran que no tratar una opción en algunos casos (y siempre consensuando con el paciente), en general se considera que el tratamiento está justificado siempre29,36. La conducta expectante no está justificada si el paciente sufre algún factor de riesgo que aumente el riesgo de progresión de la lesión, tal como la inmunosupresión, antecedente de CCE o carcinoma de células basales (CCB), presentar un elevado número de lesiones o el antecedente de una gran exposición a la radiación UV35.
Los pacientes consideran que una de las principales dificultades del tratamiento de la QA son las molestias y el dolor causados por el tratamiento, y su baja efectividad45.
Tratamiento general
Sea cual sea el método utilizado, una vez realizado el diagnóstico de QA se debe registrar tanto la localización como el grosor y gravedad de la lesión1, así como informar al paciente de la necesidad de usar protección solar.
Además, todos los pacientes necesitan información clara sobre el riesgo particular y general de evolución a CCE, de manera que puedan identificar de forma precoz cualquier síntoma de alarma que requiera atención médica, como el sangrado, un crecimiento significativo o mayor protuberancia1.
En los casos en los que sea necesario, se recomienda realizar modificaciones de los hábitos de vida del paciente, como disminuir la exposición solar o cambiar el lugar de trabajo (en los casos en los que este implique exposición solar).
La piel envejecida y expuesta al sol suele estar seca, por lo que el uso de emolientes puede constituir otro pilar importante en el tratamiento general del paciente con QA, si bien es cierto que su efecto directo no está claro. Añadir otros principios activos, como la urea o el ácido salicílico, también puede proporcionar beneficios en este sentido1.
Se ha demostrado que la fotoprotección tiene un efecto beneficioso doble (emoliente y fotoprotector) y que la aplicación diaria de protector solar de amplio espectro (contra los rayos ultravioleta A —UVA— y ultravioleta B —UVB) con un SPF de 15 o más, como parte de cualquier régimen de tratamiento, consigue prevenir el desarrollo de nuevas lesiones19,36, el número total de lesiones de QA19,36,48 e, incluso, la incidencia de CCE36,49.
Tratamiento activo
Puesto que resulta muy difícil predecir qué lesión de QA va a progresar a CCE, se recomienda tratar todas las lesiones de QA36.
Las opciones terapéuticas para pacientes con QA son diversas e incluyen cirugía, crioterapia, medicamentos tópicos, dermoabrasión o terapia fotodinámica (TFD), entre otros. A esta complejidad en la variedad terapéutica se añade la gran cantidad de agentes terapéuticos en cada grupo, sus modos de aplicación y la flexibilidad con la que se pueden utilizar. Por ello, y aunque la mayoría de los pacientes con QA pueden atenderse y tratarse de forma tópica1 en atención primaria, a la hora de decidir el tratamiento más adecuado para el paciente con QA es importante tener en cuenta la serie de factores que se recogen en la Tabla 4.
Tabla 4. Factores a considerar para la elección del tratamiento de pacientes con queratosis actínica23
| Factores asociados a la lesión |
| Naturaleza |
| Número |
| Tamaño |
| Ubicación anatómica |
| Cambio en el patrón de crecimiento |
| Sospecha de lesiones subclínicas |
| Factores asociados al paciente |
| Tolerabilidad/adherencia |
| Síntomas y problemas estéticos |
| Preferencias |
| Comorbilidad |
| Tratamiento previo de las lesiones |
| Otros factores |
| Experiencia del médico |
| Disponibilidad, eficacia y coste de las opciones de tratamiento |
Las opciones terapéuticas para pacientes con QA incluyen terapias dirigidas a las lesiones (por ejemplo, cirugía, crioterapia, dermoabrasión) y terapias dirigidas al campo de cancerización (por ejemplo, diclofenaco, fluorouracilo, imiquimod), además de la TFD.
Las opciones de tratamiento también se pueden dividir en función de si van dirigidas a tratar lesiones clínicamente visibles o palpables o si, por el contrario, pretenden tratar zonas subclínicas de queratinocitos atípicos situadas en áreas de piel con daño solar crónico (el campo de cancerización) y no solo las zonas con manifestaciones clínicas de QA36. El campo a tratar puede ser pequeño (<25 cm2) o grande (>25 cm2).
En términos generales, las opciones terapéuticas que van dirigidas a tratar la lesión —como la crioterapia, los procedimientos quirúrgicos y algunos medicamentos tópicos— constituyen la estrategia principal para tratar lesiones aisladas50, mientras que las denominadas terapias de campo —como el diclofenaco tópico, el fluorouracilo tópico, el imiquimod y la TFD— son especialmente útiles para tratar pacientes con áreas múltiples de QA y con lesiones subclínicas no detectables mediante inspección visual o la palpación (campo de cancerización)50.
Tratamiento tópico
El tratamiento tópico es de elección cuando las lesiones de QA son delgadas, especialmente las situadas en cuero cabelludo, orejas, nariz, mejillas, frente y zona perioral1. El tratamiento tópico, además de ser adecuado como tratamiento dirigido a lesiones, también lo es cuando se utiliza como tratamiento de campo, en cuyo caso debemos definir junto al paciente el tamaño del campo para garantizar la anticipación y la tolerancia de los efectos secundarios.
Se debe educar al paciente al comienzo del tratamiento sobre aspectos como la forma de aplicar el medicamento tópico y sus efectos secundarios, así como establecer un plan que permita el seguimiento de estos pacientes desde atención primaria.
Los tratamientos tópicos para la QA son los siguientes:
• 5-fluorouracilo al 5 %. El fluorouracilo al 5 % (5-FU) (no comercializado en España) es un antimetabolito quimioterapéutico que elimina la lesión al interferir con la síntesis de ADN mediante la inhibición de la timilidato-sintetasa. En menor medida, interfiere con la transcripción del ARN. Puede usarse como tratamiento dirigido a la lesión o como tratamiento de campo (hasta 500 cm2)51. Presenta una alta tasa de eliminación clínica inicial (del 50 al 96 %), aunque la tasa de recidivas a los 12 meses también es alta (55 %)23. En 2013, un metanálisis basado en una revisión Cochrane determinó que el 5-FU era el más eficaz de los tratamientos locales52, aunque otra revisión Cochrane de 2012 encontró que diclofenaco, 5-FU e imiquimod tenían una eficacia similar1. También ha resultado ser útil para el tratamiento del campo, según un ensayo clínico aleatorizado reciente53.
La reacción inflamatoria local que puede producir su uso al 5 % en tratamiento de campo puede ser importante1. No obstante, su formulación al 0,5 % combinada con ácido salicílico al 10 % comporta menos efectos secundarios23.
Parece que puede ser efectivo también como tratamiento preventivo1,54.
• 5-fluorouracilo al 4 %55. Fármaco de reciente comercialización en España. Su novedad radica en que está formulado en un vehículo acuoso que contiene aceite de cacahuete. En un estudio de no inferioridad frente a 5-FU al 5 % se vio que la eficacia no era inferior, y que además los efectos secundarios eran menores. Está indicado para el tratamiento de la QA no hiperqueratósica y no hipertrófica (grados I y II)56.
• 5-fluorouracilo al 0,5 % con ácido salicílico al 10 %. El ácido salicílico está indicado en la fase previa a la aplicación del 5-FU para eliminar la queratina que cubre la lesión. Actualmente, existe una combinación de ácido salicílico al 10 % con 5-fluorouracilo, para incrementar la penetración cutánea de este compuesto1. En un estudio pivotal de fase III para el tratamiento de QA de grados I y II en el que se comparó este fármaco con el gel de diclofenaco y un placebo, los resultados favorecieron al 5-FU. En la biopsia a las 20 semanas no hubo datos de QA en el 72 % de los pacientes del grupo tratado con 5-FU y ácido salicílico, lo cual fue significativamente mayor que en el grupo tratado con diclofenaco (59,1 %) y con placebo (44,8 %). El número de sujetos con una respuesta clínica completa fue del 55,4 % en el grupo tratado con 5-FU, el 32 % en el de diclofenaco y el 15,1 % en el de placebo. Las reacciones adversas más frecuentes fueron la irritación e inflamación en el lugar de aplicación (86,1 % y 73,3 %, respectivamente), y la tasa de interrupción del tratamiento por reacciones cutáneas fue del 0,5 %57. Alrededor del 50 % de los pacientes interrumpen el tratamiento a las 6 semanas debido a la desaparición de las lesiones1.
• Imiquimod. Se usa al 3,75 % y al 5 %. El imiquimod es un modulador de la respuesta inmunitaria. La tasa de remisión depende de la concentración y la pauta. Por ejemplo, al 5 %, aplicado 2-3 veces por semana durante 12-16 semanas, la tasa de curación varía entre el 45 % y el 84 %. La tasa de recurrencia es del 10 % al año y del 20 % a los 2 años. Consigue buenos resultados estéticos, ya que mantiene la calidad cutánea del paciente54. No obstante, puede producir una dermatitis grave, de intensidad variable, y no predecible, distinta para cada paciente43, y aumenta el riesgo de infección local58. La inflamación puede extenderse más allá de las áreas tratadas y, ocasionalmente, puede provocar síntomas gripales51.
Al 3,75 %, la tasa de remisión completa de todas las QA se consigue en el 36 % de los pacientes, y la eliminación parcial (≥75 % de las lesiones) en el 59 % de los pacientes. Esta formulación puede aplicarse en zonas más extensas que la del 5 % y en una pauta más corta23.
Consigue mejores resultados cosméticos que otros tratamientos tópicos23,54.
• Diclofenaco al 3 % en gel de ácido hialurónico al 2,5 %. El diclofenaco tiene acción antiinflamatoria y antineoplásica, mediante la inhibición de la ciclooxigenasa-2. La tasa de respuesta parcial (≥75 % de las lesiones) está en torno al 85 % a los 90 días de tratamiento, y la remisión clínica completa en el 41-50 % de los pacientes. La eficacia de un ciclo único de 90 días persiste al cabo de 1 año en la mayoría de los pacientes23.
Está indicado en pacientes con QA leves y se puede aplicar en zonas extensas (múltiples lesiones). Se aplica 2 veces al día durante 60-90 días. Es menos eficaz que el 5-FU y el imiquimod, pero también tiene menos efectos secundarios1 y muy buena tolerancia23.
El uso de ácido hialurónico como vehículo disminuye la difusión de diclofenaco a través de la piel, aumentando el tiempo de exposición de la epidermis al diclofenaco y mejorando su acción en células atípicas59.
• Tirbanibulina. Fármaco en pomada aprobado por la Agencia Europea del Medicamento en julio de 2021. Tiene un mecanismo de acción novedoso: disgrega los microtúbulos celulares, lo que provoca la interrupción del ciclo celular y la apoptosis de las células proliferativas. Su eficacia en lesiones no hiperqueratósicas ni hipertróficas fue probada en dos ensayos clínicos de fase III, con eficacia mayor que el placebo, tanto en las lesiones de la cara como en las del cuero cabelludo. La resolución fue completa en el 44 % de los pacientes del ensayo 1 y en el 54 % de los pacientes del ensayo 260. En un metaanálisis de reciente publicación en la que se comparan las odds ratios de eficacia de varias medicaciones tópicas para la QA, se concluye que la tirbanibulina posee una eficacia similar al resto de tratamientos tópicos para la QA y un perfil favorable de seguridad61.
La posología es de una aplicación al día, en capa fina, durante 5 días consecutivos. Cada día se debe aplicar el contenido de un sobre y desechar el contenido sobrante. La superficie máxima que se puede tratar es de 25cm2. El efecto terapéutico debe evaluarse a las 8 semanas del tratamiento62.
Se trata de un fármaco seguro que no precisa ajuste de dosis por edad, insuficiencia renal ni hepática, y tiene bajo riesgo de interacciones62. Los efectos secundarios fueron en general leves, probablemente debido a que su mecanismo de acción diferente propicia una liberación de citoquinas menor. Los más frecuentes son el eritema y la descamación locales63.
De todos estos tratamientos, los más apropiados para usar en atención primaria ―aparte de conducta expectante con emolientes y protección solar― son el diclofenaco al 3 % en gel y la combinación de 5-FU 0,5 % y ácido salicílico 10 % (hay que tener en cuenta que la tirbanibulina no se había comercializado todavía cuando se publicaron las guías británicas que hacen esta afirmación)1.
Siempre debe advertirse de la posibilidad de efectos secundarios con el tratamiento y cómo actuar. La mayoría causan enrojecimiento, inflamación y, a veces, costras, lo cual puede llevar al abandono del tratamiento si no se está advertido. Las estrategias para minimizarlos incluyen las siguientes1:
- usar emolientes;
- aumentar el intervalo de aplicación;
- hacer breves descansos en el tratamiento;
- en algunos casos, aplicar corticoides tópicos.
La Tabla 5 recoge las principales características y efectos secundarios de las opciones terapéuticas tópicas para pacientes con QA.
Tabla 5. Principales opciones terapéuticas tópicas para la queratosis actínica
| Fármaco y concentración (%)* | Presentación | Posología | Manejable en atención primaria | Efectos secundarios | Tipo de tratamiento |
| 5-fluorouracilo al 4 % | Crema 40 mg/g | 1 aplicación al día durante 4 semanas | ••* | Trastornos en el lugar de aplicación (incidencia 62 – 69 %): eritema, descamación/sequedad, edema, costras, erosiones, punzadas/ardor y prurito. Irritación ocular | Lesiones |
| 5-fluorouracilo al 0,5 % combinado con ácido salicílico al 10 % | Solución tópica 5/100 mg/g |
1 aplicación al día en piel afecta (hasta 25 cm2) hasta la desaparición de la lesión o un máximo de 12 semanas. | ••• | Reacciones cutáneas en el lugar de aplicación: – Muy frecuentes: eritema, inflamación, irritación (incluyendo quemazón), dolor, prurito, exfoliación, cefalea. – Frecuentes: sangrado, erosión, costras. |
Campo pequeño (hasta 25 cm2) |
| Imiquimod 5 % | Crema 12-24 sobres |
3 aplicaciones a la semana en ciclos de 4 semanas con descansos de otras cuatro semanas. | •• | -Muy frecuentes: prurito. -Frecuentes: reacción en el sitio de aplicación, dolor, quemazón, irritación, eritema, fatiga, anorexia, náuseas, mialgia, artralgia. |
Campo pequeño (máximo 25 cm2) |
| Imiquimod 3,75 % | Crema 28-56 sobres |
1 vez al día durante 2 semanas, seguido de 2 semanas de descanso y otras 2 semanas de aplicación. |
•• | Tiene menos efectos secundarios que la formulación al 5 %: -Muy frecuentes: eritema, costras, exfoliación, edema, úlcera, hipopigmentación, sequedad, supuración. -Frecuentes: reacción en el sitio de aplicación, prurito, dolor, quemazón, tumefacción, irritación, exantema, fatiga, pirexia, síntomas gripales, mialgia, artralgia, náuseas, diarrea, vómitos, cefaleas, vértigo, insomnio, anorexia, linfadenopatía, herpes simple. |
Lesiones múltiples y campo de cancerización. Áreas de hasta 200 cm2. |
| Diclofenaco al 3 % | Gel 60 g y 90 g |
Aplicar la crema 2 veces al día durante 2-3 meses. La cantidad necesaria depende del tamaño de la lesión. | ••• | -Frecuentes: reacciones en la zona de aplicación, dermatitis (incluida la dermatitis de contacto), eccema, piel seca, eritema, edema, prurito, erupción, exantema escamoso, hipertrofia cutánea, úlcera cutánea, erupción vesicular, conjuntivitis, hiperestesia, hipertonía, parestesia localizada. | Campo grande, hasta 200cm2 |
| Tirbanibulina 1 % | Pomada 5 sobres de 250 mg |
1 aplicación al día durante 5 días. | •••*** | Leves. Los más frecuentes son eritema (91 %) y descamación (82%). Provoca dolor en el 10% de los pacientes y prurito en el 9% | Lesiones en campo pequeño (máximo 25cm2) |
Fuente: elaboración propia a partir de las British Association of Dermatologists’ Guidelines1 y las fichas técnicas de los productos56,62,64-67.
❍ no manejable; • cierto manejo; •• manejo moderado; ••• muy manejable. *No se incluye el 5-FU 5 % por no estar comercializado en España. **El 5-fluorouracilo al 5 % aparece con esta clasificación en la guía británica; los efectos adversos de la formulación al 4% parecen ser menores, por lo que es posible que su manejabilidad en atención primaria sea mayor. ***La clasificación en esta tabla se ha establecido en función de su perfil de seguridad y su cómoda posología.
En los casos en los que haya una falta de respuesta al tratamiento tópico, será necesario realizar nuevas intervenciones, bien mediante la derivación del paciente a atención secundaria o bien mediante cirugía para obtener una muestra histológica y ampliar el tratamiento1.
En cuanto a qué tratamiento es mejor en cada situación, la falta de homogeneidad entre los estudios disponibles no permite su comparación. Recientemente se ha definido un conjunto básico de criterios de valoración que todos los estudios sobre estos fármacos deberían incluir, para poder tomar decisiones basadas en la evidencia. Estos son: eliminación completa de las lesiones, porcentaje de lesiones eliminadas, gravedad de las reacciones adversas, efectividad desde la perspectiva del paciente, preferencia de tratamiento futuro (según el paciente), y tasa de recurrencia68.
Crioterapia
Se trata de una terapia dirigida a la lesión, que consiste en la aplicación de nitrógeno líquido. Es una de las opciones terapéuticas más utilizadas y de preferencia en el caso de pacientes con 1-6 lesiones aisladas en diferentes localizaciones anatómicas1,29. Es el tratamiento de elección en las regiones perioral y periocular (siempre que sea aplicada por un especialista)1.
Es un tratamiento fácil, rápido y barato. Sin embargo, la técnica no está estandarizada; es decir, no existen unas pautas claras sobre la duración de la aplicación, la intensidad o la frecuencia con que debe repetirse23,51, lo cual repercute en su eficacia1.
Sus efectos adversos a corto plazo (como el dolor y la inflamación) y a largo plazo (cicatrización e hipopigmentación)1 la convierten en una terapia menos apropiada para pacientes con múltiples lesiones.
Terapia fotodinámica
No es un método puramente mecánico, sino mixto. Consiste en la administración de un agente fotosensibilizante, que se acumula en las células cancerígenas y se activa cuando se hace incidir sobre la lesión la luz con la longitud de onda adecuada. Su activación produce la destrucción selectiva de las células cancerígenas por radicales libres de oxígeno, sin dañar los tejidos circundantes. Entre los agentes fotosensibilizantes, los más utilizados en dermatología son el ácido 5-deltaaminolevulínico (ALA) y el metilaminolevulinato (MAL)23.
La TFD es el tratamiento de elección en pacientes con lesiones individuales no hiperqueratósicas y numerosas que afectan a zonas faciales y del cuero cabelludo. El paciente tipo para este tipo de terapia es aquel que presenta lesiones de QA grado 1-3 múltiples, especialmente aquellos con afectación amplia en áreas fotoexpuestas (cara y cuero cabelludo)69. También son una buena opción para el tratamiento de las extremidades, sobre todo si el fotosensibilizador se incuba a temperaturas elevadas.
Constituye un tratamiento especialmente adecuado en pacientes con campo de cancerización, ya que permite el tratamiento tanto de las lesiones clínicamente visibles como de las subclínicas69,70. En este sentido, las terapias con ALA o MAL han demostrado una alta eficacia71. La eficacia es menor en inmunodeprimidos24,29.
Un importante problema de la TFD es el consumo de tiempo del paciente, ya que tiene que acudir al hospital varias veces. En los últimos años se ha perfeccionado la TFD con luz de día, que se considera de primera línea para las lesiones de grado 1 y 2 en cara y cuero cabelludo. La crema fotosensibilizadora se aplica en casa, el paciente se expone a la luz de día, y retira la crema a las 2 horas con agua y jabón29. Durante el resto del día debe protegerse del sol con ropa adecuada y un protector solar mineral24. Es menos dolorosa que la TFD tradicional35. Se considera tan eficaz como la TFD convencional, aunque puede variar en función del área geográfica24, el clima y la estación51.
La fototerapia, junto con el imiquimod, son los tratamientos que dan mejores resultados cosméticos54.
Tratamiento quirúrgico
Los procedimientos quirúrgicos son interesantes para tratar lesiones aisladas sospechosas de malignidad, para las que es necesaria una biopsia32. Hay que tener en cuenta que habitualmente en pacientes con QA no se puede hacer una extirpación con márgenes de seguridad24, debido a su localización y al mal estado de la piel circundante.
Las opciones son la escisión quirúrgica, el raspado y el curetaje. Para su aplicación se requiere formación e instrumentación51.
Terapia con láser, dermoabrasión y exfoliación química
Estos tratamientos, puesto que conllevan la destrucción dérmica a una profundidad controlada, pueden ser otra opción terapéutica para pacientes con QA, si bien se consideran de segunda línea. Estas terapias físicas conllevan un riesgo significativo de efectos secundarios a largo plazo, como hipopigmentación, eritema persistente y cicatrización, especialmente las técnicas de láser ablativas, que además requieren profilaxis antibiótica1.
Tratamiento sistémico
El tratamiento sistémico por lo general se administra como prevención secundaria en pacientes con múltiples QA de grado 3, historia de CCE múltiples e inmunosupresión1. Nunca es un tratamiento de primera línea.
Este tratamiento puede realizarse con un retinoide sistémico (acitretina) y siempre formando parte de una decisión multidisciplinar, ya que el empleo de este tratamiento puede asociarse a una considerable morbilidad y un posible efecto de rebote tras su suspensión1,72. Puede estar justificado en pacientes de muy alto riesgo, como los receptores de trasplantes de órganos, donde existe un posible aumento del riesgo de progresión de QA a CCE72, aunque su eficacia sobre la QA no ha sido reportada1,24. Sí es común recetarlo cuando los pacientes han presentado múltiples CCE sobre lesiones de QA1,24.
Aunque disponemos de poca literatura sobre el tratamiento con citotóxicos sistémicos en inmunosuprimidos, la capecitabina en pacientes trasplantados con CCE, CCB o QA frecuentes ha mostrado disminuir la incidencia mensual de estas lesiones en un 22 %, 33 % y 45 %, respectivamente, de los niveles de pretratamiento1,73. Sin embargo, su uso se halla limitado por la toxicidad1.
Por otra parte, el tratamiento con celecoxib (un inhibidor de la ciclooxigenasa-2) durante 9 meses puede reducir el número de lesiones de CCB y CCE, pero no parece modificar el número de lesiones de QA74, por lo que no hay datos que apoyen su papel terapéutico en pacientes con QA75.
Combinaciones de tratamientos
Otras estrategias terapéuticas más novedosas para el tratamiento de las QA combinan tratamientos dirigidos a las lesiones y tratamientos dirigidos al campo, consiguiendo de esta forma optimizar el aclaramiento de las lesiones visibles y discretas, así como de las lesiones subclínicas en piel con daño solar76. Estas combinaciones pueden ser de dos tipos, según el tipo de aplicación:
- Secuencial, en la que un tratamiento sigue a otro en función de los resultados obtenidos.
- Simultánea, en la que se utilizan dos principios activos para potenciar la eficacia1.
Algunos ejemplos de tratamientos combinados de forma secuencial son77:
- Diclofenaco 3 % en gel de ácido hialurónico78 o 5-FU seguidos de crioterapia58.
- Crioterapia seguida de imiquimod 5 %29,58,79.
- TFD antes o después de 5-FU o imiquimod77.
- Diclofenaco 3 % en gel de ácido hialurónico seguido de 5-FU 0,5 % con ácido salicílico79.
Un ejemplo de combinación simultánea es la asociación de ácido salicílico al 10 % con 5-FU; en este caso, el ácido salicílico actúa como queratolítico superficial, por lo que mejora así la penetración y, por lo tanto, la eficacia del 5-FU23.
¿Qué estrategia terapéutica elegir?
En general, se necesitan más estudios comparativos entre los diferentes tratamientos disponibles para poder escoger la mejor opción en cada caso54. También se necesitan más estudios que midan la efectividad a largo plazo36. En un metaanálisis reciente en el que se evaluó el mantenimiento de la respuesta completa a los 12 meses tras el tratamiento, el tratamiento más favorable fue la TFD con ALA, seguida del imiquimod al 5 %, PDT con MAL y la crioterapia80. En otro estudio de coste-efectividad se señaló al 5-FU 5 % como el más coste-efectivo, seguido del imiquimod 5 % y por último la TFD con MAL81.
Ante el amplio abanico de opciones terapéuticas del que disponemos, se han elaborado diferentes algoritmos clínicos.
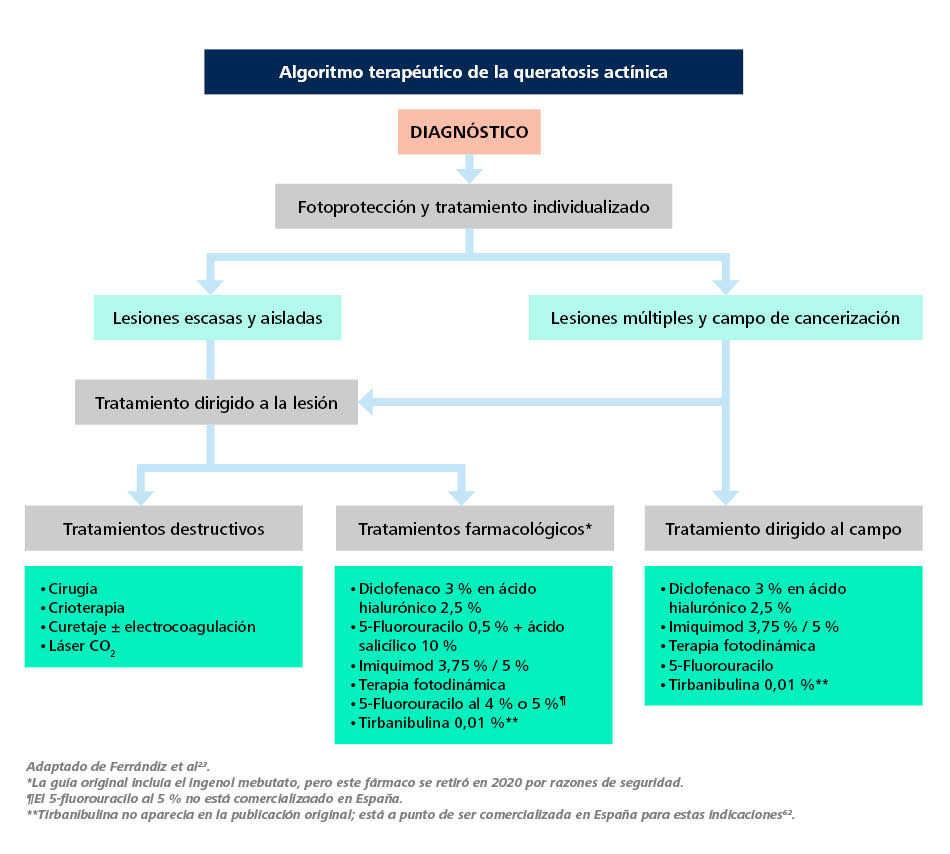
Ferrándiz et al., en su Adaptación española de la Guía europea para la evaluación y tratamiento de la QA23, proponen el algoritmo de tratamiento de la Figura 4.
Figura 4. Algoritmo de tratamiento de la queratosis actínica
Adaptado de Ferrándiz et al23. *Tirbanibulina no aparecía en la publicación original; está a punto de ser comercializada en España para estas indicaciones62. **La guía original incluía el ingenol mebutato, pero este fármaco se retiró en 2020 por razones de seguridad.
Fracaso del tratamiento
Aunque todos los tratamientos tienen un riesgo potencial de fracaso, cuando esto ocurre o la lesión recidiva, se recomienda cirugía con objeto de obtener material para realizar un examen anatomopatológico con el fin de descartar un CCE invasivo23. En un estudio reciente se vio que las QA resistentes al tratamiento eran más dolorosas, y en el estudio histológico tenían más acantolisis y una proliferación basal distinta82.
Otra posibilidad es que el diagnóstico sea incorrecto o que, en realidad, continúan apareciendo nuevas lesiones. Esto no traduce el fracaso del tratamiento, sino la naturaleza de la enfermedad1.
Una vez que un paciente se diagnostica de QA, es probable que necesite tratamiento intermitente de por vida1.
Tratamiento de las queratosis actínicas en situaciones específicas de riesgo
Existen algunas situaciones que ameritan un enfoque particular.
Pacientes inmunodeprimidos y receptores de trasplante de órgano sólido
El tratamiento de las QA en este grupo de pacientes es menos efectivo, tal vez porque las lesiones son más proliferativas e hiperqueratósicas o porque nuevas lesiones aparecen con rapidez en las zonas tratadas1.
Estos pacientes precisan medidas preventivas rigurosas (como fotoprotección extrema), así como revisiones periódicas para detectar y tratar las QA de forma precoz1,23. Si apareciesen QA, puede ser necesario modificar la terapia inmunosupresora (por ejemplo, suspender la azatioprina) y tomar otras medidas preventivas, como asegurar la ingesta de vitamina B635.
En cuanto al tratamiento, se recomienda combinar procedimientos físicos que permitan el estudio anatomopatológico de la lesión con tratamientos farmacológicos que incrementen la efectividad y permitan tratar el campo de cancerización23,83. Entre ellos destacan, por su efectividad y seguridad demostrada en pacientes trasplantados, el diclofenaco en gel de ácido hialurónico, el imiquimod, la TFD y el 5-FU83. Un metaanálisis reciente ha investigado las ventajas del uso de TFD en receptores de trasplante, con la cual se obtienen mejores resultados cosméticos y es útil tanto para el tratamiento como para la prevención de QA y CCE84.
Otros pacientes de riesgo
Otras circunstancias que aumentan el riesgo de evolución de la QA a CCE son las siguientes:
- QA múltiples y confluentes1;
- lesiones localizadas en los labios, orejas y zona periocular: los carcinomas localizados en estas zonas tienen mayor potencial metastatizante23;
- QA en personas con antecedentes de CCE invasivo23;
- QA secundarias a radiaciones ionizantes23;
- QA en pacientes infectados por el VIH23.
En estas situaciones, al igual que en los pacientes inmunosuprimidos, se recomienda utilizar técnicas que permitan el estudio anatomopatológico1,23, aunque pueden combinarse con tratamientos tópicos23.
Tratamiento en localizaciones específicas
La morbilidad de las QA varía según la localización; además, hay tratamientos más apropiados para unas localizaciones que para otras:
- Zona periocular. El problema de esta zona es el riesgo de efectos adversos en el ojo. La ficha técnica de todos los tratamientos tópicos advierte en este sentido, y el nitrógeno líquido puede usarse, pero con cuidado de que el vapor no entre en el ojo. La cirugía es otra opción, con cuidado de respetar la función del párpado47. Por tanto, aunque es posible tratarlas, debe hacerse con instrucciones claras y una supervisión muy estrecha, y siempre en atención especializada1.
- Orejas. El riesgo de metástasis del CCE es mayor en esta localización, por lo que tratar las QA es prioritario. Deben biopsiarse siempre que sea posible47, o al menos cuando sean lesiones con base indurada o de grado 31.
- Labios. La queilitis actínica, un tipo de QA, es la lesión premaligna más frecuente del labio y se asocia a la exposición prolongada al sol. Su prevalencia es alta en hombres de piel clara ≥40 años y en personas que trabajan o practican actividades recreativas al sol. El tratamiento puede ser tópico (incluyendo TFD)69 o quirúrgico, aunque no se ha establecido cuál es el óptimo47.
- Antebrazos y manos. Las QA del dorso de las manos suelen ser múltiples e hiperqueratósicas. Está indicado el tratamiento precoz con fármacos tópicos o TFD, ya que podría reducir la necesidad de escisión quirúrgica futura. La piel de esta zona tolera mejor la irritación y otros efectos secundarios, por lo que a veces es posible alargar el tratamiento. Esto puede ser necesario, ya que la piel es más gruesa y además la hiperqueratosis puede empeorar la penetración del producto. El 5-FU combinado con ácido salicílico es útil para tratar las QA de grado 3 del antebrazo y el dorso de la mano1.
- Debajo de la rodilla. Las QA en esta localización con frecuencia coexisten con CCE in situ, y la predisposición a desarrollar cáncer diferente de melanoma (incluido el CCB) es mayor. Por otro lado, es una zona con tendencia a curar peor, por lo que debe buscarse el equilibrio entre la necesidad de tratar y los riesgos de hacerlo (incluidas la falta de curación y la infección). Por eso, suelen ser precisos regímenes de tratamiento más flexibles1.
Una opción es el tratamiento intermitente, de baja intensidad y crónico. Una forma usada habitualmente es la aplicación de 5-FU al 5 % de forma semanal, dejándolo con un vendaje oclusivo durante 7 días, y repetir durante 4 a 8 semanas1,24. En pacientes reacios a no lavarse las piernas durante 7 días, se puede aplicar 5-FU dos veces al día y dejar una oclusión nocturna con un plástico, durante 4 semanas24. Puede ser preciso interrumpir temporalmente el tratamiento si se produce pérdida de la integridad cutánea. El diclofenaco al 3% en gel de ácido hialurónico es una alternativa con menos efectos secundarios, pero la efectividad puede ser menor. Otra opción es la TFD1, aunque es menos efectiva en regiones acrales70.
Algoritmo de tratamiento en pacientes de riesgo
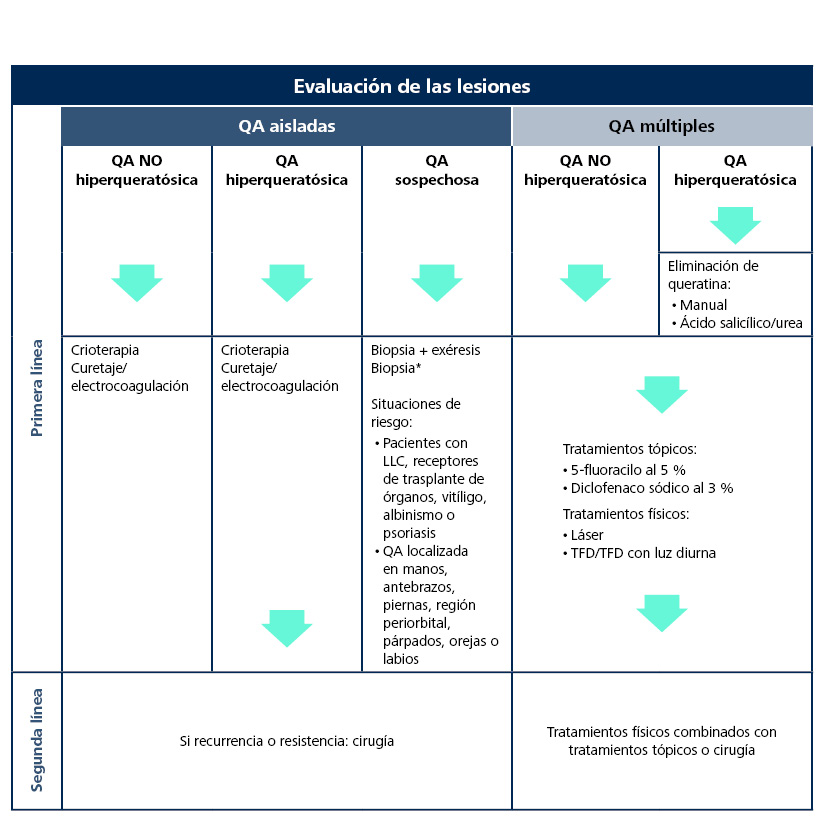
La propuesta de tratamiento elaborada por clínicos expertos de AKTeamTM (Tabla 7) refleja, además del abordaje según el tipo de lesión, la necesidad de biopsiar las QA en las localizaciones y en los pacientes de riesgo de evolución a CCE47.
Tabla 7. Algoritmo de tratamiento de la queratosis actínica, incluidas situaciones específicas de riesgo47
*Si se confirma que se trata de una queratosis actínica, realizar el tratamiento según el algoritmo
LLC: leucemia linfocítica crónica; TFD: terapia fotodinámica
Precisan biopsia las QA en pacientes inmunosuprimidos y receptores de trasplante de órganos, así como en pacientes con vitíligo, albinismo o psoriasis. También deben biopsiarse las QA localizadas en manos, antebrazos, piernas, región periorbital, párpados, orejas o labios47.
¿Cuál es el pronóstico y curso clínico de la QA?
En cuanto a su curso clínico, la QA se considera una lesión premaligna que puede progresar a cáncer de piel invasivo. En este sentido, la probabilidad de que una lesión de QA progrese a CCE es baja (entre el 0,03 % y el 20 %)5,85, si bien es cierto que aproximadamente el 60 % de los carcinomas cutáneos de células escamosas se originan en lesiones de QA preexistentes86. En un estudio de cohortes de 10 años de duración, se vio que el riesgo de CCE aumenta un 1,92 % cada año, y que los pacientes diagnosticados de QA antes de los 49 años tienen un riesgo 7 veces mayor de desarrollar CCE que aquellos que no tienen QA20. El riesgo también es mayor en pacientes que tienen más de 5 lesiones29,51,58, y aumenta proporcionalmente al número de estas20. Sin embargo, es imposible predecir el potencial de malignización individual de cada lesión29,51,58.
Por otra parte, las lesiones que no progresan a formas malignas pueden persistir como QA o incluso remitir espontáneamente5,87 (especialmente en el caso de lesiones de grado 1 y 2). El porcentaje de remisión de las lesiones de QA oscila entre el 20 % y el 30 % al año, y puede alcanzar valores de hasta el 63 % anual. No obstante, una vez que remiten, las lesiones pueden reaparecer posteriormente con una probabilidad anual de entre el 15 % y el 53 %58,88.
Además, la presencia de QA sirve como indicador de la existencia de daño solar crónico y, por lo tanto, de mayor riesgo de desarrollar CCE y CCB en otros lugares40,89,90. También el aumento de la edad y la presencia de QA se correlacionan con un mayor riesgo de desarrollar CCE y CCB, así como melanoma maligno91.
¿Cómo prevenir la QA?
Desde el punto de vista de la prevención primaria, existen una serie de medidas útiles para prevenir el desarrollo de QA. Así, se recomendarán al paciente medidas preventivas como las siguientes36:
- evitar la exposición solar (especialmente entre las 11 a. m. y las 2 p. m.);
- usar ropa protectora: manga larga, pantalones largos, gorra o sombrero que cubran lo máximo posible y gafas de sol;
- aplicar protectores solares de amplio espectro y factor de protección solar (FPS) de 30 o más.
Estas medidas, además de prevenir el desarrollo de nuevas lesiones de QA19,58, también acelerarán la tasa de remisión de las lesiones ya existentes92. Por último, es muy importante insistir a los pacientes de alto riesgo en el autocuidado y que sepan cómo realizar una autoexploración, ya que será útil a la hora de detectar cambios sospechosos de transformación maligna1.
Desde el punto de vista de la prevención secundaria en pacientes con QA, de igual forma deberemos recomendar que eviten la exposición excesiva al sol, (especialmente entre las 11 a. m. y las 2 p. m.), el uso de ropa protectora cuando estén al aire libre y de protector solar de amplio espectro (con al menos un FPS de 30 y 3 o 4 veces al día) sobre áreas expuestas al sol. Además, insistiremos en la importancia de realizar autoexploraciones para detectar malignizaciones o nuevas lesiones de QA.
En cuanto a tratamientos preventivos, se están empezando a investigar algunos fármacos tópicos, como el 5-FU1,54 o la TFD70.
Últimas guías publicadas
- Guía para el manejo de la queratosis actínica de la Academia Americana de Dermatología:
https://www.jaad.org/article/S0190-9622(21)00502-8/fulltext
Eisen DB, Asgari MM, Bennett DD, et al. Guidelines of care for the management of actinic keratosis. J Am Acad Dermatol. 2021;85(4):e209-e233.
- Guía de la de la Asociación Británica de Dermatólogos para el cuidado de pacientes con queratosis actínica:
https://doi.wiley.com/10.1111/bjd.15107
De Berker D, McGregor JM, Mohd Mustapa MF, Exton LS, Hughes BR. British Association of Dermatologists’ guidelines for the care of patients with actinic keratosis 2017. Br J Dermatol. 2017 Jan;176(1):20–43.
- Guía basada en la evidencia y el consenso (S3) para el tratamiento de la queratosis actínica, elaborada por la Liga Internacional de Sociedades Dermatológicas en cooperación con el Foro Europeo de Dermatología:
https://doi.wiley.com/10.1111/jdv.13180
Werner RN, Stockfleth E, Connolly SM, Correia O, Erdmann R, Foley P, et al. Evidence- and consensus-based (S3) Guidelines for the Treatment of Actinic Keratosis – International League of Dermatological Societies in cooperation with the European Dermatology Forum – Short version. J Eur Acad Dermatol Venereol. 2015 Nov;29(11):2069-79.
- Guía basada en la evidencia y el consenso (S3) para el diagnóstico y tratamiento de las queratosis actínicas, elaborada por un grupo cooperativo de las Sociedad del Cáncer y la Sociedad Dermatológica alemanas:
https://onlinelibrary.wiley.com/doi/10.1111/ddg.14048
Heppt MV, Leiter U, Steeb T, et al. S3 guideline for actinic keratosis and cutaneous squamous cell carcinoma – short version, part 1: diagnosis, interventions for actinic keratoses, care structures and quality-of-care indicators. J Dtsch Dermatol Ges. 2020;18(3):275-294.
- Guía del Foro Europeo de Dermatología sobre terapia fotodinámica tópica:
https://onlinelibrary.wiley.com/doi/10.1111/jdv.16017
Morton CA, Szeimies RM, Basset-Seguin N, et al. European Dermatology Forum guidelines on topical photodynamic therapy 2019 Part 1: treatment delivery and established indications – actinic keratoses, Bowen’s disease and basal cell carcinomas. J Eur Acad Dermatol Venereol. 2019;33(12):2225-2238.
- Guía canadiense sobre el manejo de las queratosis actínicas:
https://journals.sagepub.com/doi/ 10.1177/1203475415583414
Poulin Y, Lynde CW, Barber K, Vender R, Claveau J, Bourcier M, et al. Non-melanoma skin cancer in Canada chapter 3: Management of actinic keratoses. J Cutan Med Surg. 2015 May 9;19(3):227–38.
- Consenso español-portugués sobre el uso de la terapia fotodinámica mediada por la luz diurna con metil-aminolevulinato en el tratamiento de la queratosis actínica:
https://www.ncbi.nlm.nih.gov/pubmed/26115793
Gilaberte Y, Aguilar M, Almagro M, et al. Spanish-Portuguese consensus statement on use of daylight-mediated photodynamic therapy with methyl aminolevulinate in the treatment of actinic keratosis. Actas Dermosifiliogr. 2015;106(8):623-631.
- Guía para el manejo de la queratosis actínica en lugares corporales específicos en pacientes con alto riesgo de lesiones carcinomatosas: consenso de expertos del AKTeamTM de médicos expertos:
https://www.ncbi.nlm.nih.gov/pubmed/29235161
Richard MA, Amici JM, Basset-Seguin N, Claudel JP, Cribier B, Dreno B. Management of actinic keratosis at specific body sites in patients at high risk of carcinoma lesions: expert consensus from the AKTeam™ of expert clinicians. J Eur Acad Dermatol Venereol. 2018;32(3):339-346.
Recursos relacionados
- Consulta rápida: Diagnóstico diferencial de lesiones de la piel
- Consulta rápida: Queratosis actínica. ¿Cómo se trata en atención primaria?
- Consulta rápida: Queratosis actínica. ¿Cuándo derivar a dermatología?
- Consulta rápida: Queratosis actínica: factores de riesgo más importantes
- Artículos científicos: Conjunto mínimo de criterios de valoración para los ensayos clínicos sobre queratosis actínica
- Formación: QUIZ: ¿Cuánto sabes de la queratosis actínica?
Recursos en línea y apps para médicos
Los recursos disponibles en Internet en referencia a la QA suelen estar relacionados con información general sobre dermatología y, en particular, sobre el cáncer de piel.
Los más útiles para el médico son aquellos avalados por sociedades dermatológicas y los que contienen guías visuales que permiten al profesional mantener actualizados sus conocimientos sobre la patología.
Recursos relacionados
- Sección: Webs y apps para médicos
Webs de dermatología para médicos
Academia Española de Dermatología y Venereología (AEDV)
Se trata de una sociedad médico-científica que tiene por objeto fomentar el estudio de la piel y de sus enfermedades. Está orientada fundamentalmente a dermatólogos. Parte de sus recursos son de solo para socios y parte son de acceso libre.
Proporciona información sobre el Congreso Nacional AEVD y otras reuniones y eventos de dermatología. Posee una biblioteca virtual para socios. En la sección APPTECA hay una colección de aplicaciones para dispositivos móviles útiles para los profesionales sanitarios.
European Dermatology Forum (EDF)
Es el sitio web de una organización sin ánimo de lucro dedicada a mejorar el estado de esta especialidad médica a nivel europeo. Aquí se pueden encontrar y descargar las guías clínicas europeas vigentes, incluidas las de queratosis actínica.
American Academy of Dermatology (AAD)
Es el sitio web de la asociación de dermatólogos más numerosa y representativa de Estados Unidos (en inglés). Para los profesionales hay una sección que recoge las guías clínicas vigentes, además de otros recursos interesantes.
El Instituto Nacional del Cáncer de los Estados Unidos proporciona información sobre el cáncer de piel tanto para profesionales de la salud como para pacientes. Se puede acceder a la versión en inglés y en español. Para profesionales, cuenta con los siguientes recursos:
- Información sobre la prevención del cáncer de piel.
- Información sobre el tratamiento del cáncer de piel, incluido el melanoma.
- Últimas novedades de investigación.
- Estadísticas y epidemiología.
- Recursos de prevención del cáncer de piel para profesionales de la salud.
Se trata de un portal de difusión informativa dirigida a profesionales sanitarios y dedicado específicamente a avances médicos y tratamientos. Tiene artículos sobre queratosis actínica, como Queratosis Actínica, el precáncer más común o Los rayos UVA pueden contribuir a acelerar el proceso de queratosis actínica.
Apps de dermatología para médicos
Dermoscopy Two Step Algorithm
App diseñada para entrenar a los médicos para interpretar los patrones dermatoscópicos, a través de una serie de preguntas que llevan al diagnóstico más probable. Contiene más de 80 imágenes de lesiones, tanto melanocíticas como no melanocíticas, y cuadros para ayudar al diagnóstico, además de 50 casos interactivos.
Disponible en inglés para dispositivos con sistema Android e IOS.
AKASI calculator
El índice AKASI (índice de gravedad del área con queratosis actínicas, por sus siglas en inglés) ha sido diseñado por la Asociación Europea de Dermato-oncología para evaluar cuantitativamente la gravedad de las queratosis actíncias de la cabeza. La puntuación final varía entre 0 (sin queratosis actínicas) y 18 (máximo).
La aplicación está disponible en varios idiomas, incluido el español, para IOS.
eDerma
Aplicación gratuita que permite el seguimiento de las lesiones de la piel. El propio paciente realiza fotos de sus lesiones y la app las guarda de forma ordenada. De esta forma tanto el médico como el paciente pueden ver la evolución; puede ayudar al paciente a decidir cuándo consultar.
Dispone también de un servicio de alertas de la intensidad de la radiación ultravioleta.
Está avalada por la Academia española de dermatología y venereología.
Se encuentra disponible en varios idiomas, incluido el español, en Android e IOS.
VisualDx
Es un completo atlas con más de 45000 imágenes médicas y 3200 diagnósticos que permite al médico de familia y al dermatólogo construir diagnósticos diferenciales, reconocer enfermedades concretas, incluidas infecciones y reacciones medicamentosas, y ponerse a prueba con sus encuestas.
Se trata de una aplicación de pago, disponible en inglés tanto en Android como en IOS.
Información para pacientes
Descargar en PDF los consejos para pacientes con queratosis actínica
Introducción
La causa más frecuente de QA es la excesiva exposición al sol. Esta exposición a los rayos ultravioleta de la luz solar causa, a largo plazo, cambios en el tamaño, la forma y la organización de las células de la piel conocidas como queratinocitos23.
En la mayoría de los casos, la QA se puede tratar y curar. El resultado es más favorable si se detecta la enfermedad en sus primeras etapas.
¿Qué es la queratosis actínica?
La queratosis actínica es una enfermedad de la piel en la que se producen una o varias manchas o lesiones ásperas y escamosas, rasposas a la piel, levemente rojizas, en partes del cuerpo que están expuestas al sol23.
Estas lesiones se consideran precancerosas. Si no se tratan, pueden evolucionar hasta convertirse en un tipo de cáncer llamado carcinoma invasivo de células escamosas, que, en raras ocasiones, puede causar metástasis (diseminación del cáncer de una parte del cuerpo a otra)1.
¿Cuáles son los síntomas de la queratosis actínica?
Una queratosis actínica puede aparecer como un área en la piel abultada y rasposa, y su color puede ser rosa, rojo, o marrón; a veces es del mismo color que la piel normal. Las queratosis actínicas se desarrollan más comúnmente en las partes del cuerpo que están más expuestas al sol, como la cara, las orejas, el cuello, el dorso de las manos o los antebrazos31.
Si los labios se pelan o se agrietan, especialmente si es el labio inferior después de estar al sol, también puede ser una señal de queratosis actínica. En este caso, se llama queilitis actínica33.
¿Qué causa la queratosis actínica?
La causa más frecuente de queratosis actínica es la excesiva exposición al sol (también a la luz de las cabinas de rayos ultravioleta A —UVA). La exposición a los rayos ultravioletas de la luz solar causa, a largo plazo, cambios en el tamaño, la forma, y la organización de las células de la piel conocidas como queratinocitos, que forman el 90 % de la epidermis (la capa más exterior de la piel)23.
La queratosis actínica, ¿avanzará desde una lesión superficial hasta convertirse en cáncer invasivo?
Si tienes queratosis actínica, es posible que tengas un mayor riesgo de padecer carcinoma de células escamosas invasivo. Este riesgo es bajo, pero existe. No hay manera de saber si la queratosis actínica avanzará hasta convertirse en ese tipo de cáncer o no, o cuán rápido podría suceder esto36.
La evolución a carcinoma invasivo es mayor en las lesiones localizadas en los labios y las orejas23.
¿Quién tiene riesgo de tener queratosis actínica?
Tienes más riesgo de desarrollar queratosis actínica si:
- tienes la piel clara, los ojos azules o verdes y el pelo rubio o pelirrojo10,16.
- tu sistema inmunológico está debilitado por alguna enfermedad o por un tratamiento, por ejemplo, si te han sometido a trasplante1.
- eres de edad es avanzada y tu piel ha sido dañada durante años por la exposición al sol10.
- trabajas al aire libre (eres albañil, agricultor, pescador…) o practicas o has practicado deporte al aire libre de forma continuada (golfista, tenista, regatista…)23.
¿Es hereditaria la queratosis actínica?
La queratosis actínica no es hereditaria, pero algunos factores de riesgo de padecerla sí lo son. Se heredan el tono de piel y el color de los ojos de los padres, y los individuos con piel y ojos claros tienen un riesgo más alto de desarrollar este tipo de lesiones. Por lo tanto, si tus padres tuvieron queratosis actínicas y tienes un tono de piel y color de ojos parecidos, tienes una probabilidad más alta que otras personas de desarrollarlo también21.
¿Cómo se puede prevenir la queratosis actínica?
La mejor manera de prevenir la queratosis actínica es reducir la exposición al sol, especialmente durante las horas en las que el sol está en su punto más alto y su luz es más intensa1. Algunas medidas para reducir la exposición solar son las siguientes:
- Vístete con camisas de manga larga, pantalones largos y un gorro para proteger las zonas de la piel expuestas al sol.
- Aplícate crema protectora con un factor de protección solar (SPF, de Solar Protection Factor) de 30 o más alto, al menos 30 minutos antes de salir a la calle. Se recomienda una crema solar de amplio espectro para proteger la piel tanto de los rayos UVA como de los ultravioleta B, y debe usarse también en días nublados.
- Evita tomar el sol o usar cabinas de rayos UVA para broncearte. Como sustituto, puedes usar productos autobronceadores.
¿Cuándo debo acudir al médico?
Los individuos con riesgo deberían revisarse la piel con regularidad. Si notas cualquier bulto persistente o mancha de color, textura, forma, o tamaño inusual, debes contactar con tu médico. Otros signos preocupantes son los granos que no se curan o las alteraciones de la piel que sangran con facilidad1.
Si ya estás en tratamiento para la queratosis actínica, deberás acudir al médico en las siguientes circunstancias:
- Si la piel te pica o sientes como si te quemara cuando te aplicas los medicamentos.
- Si presentas síntomas nuevos o empeoran los que tenías.
- Si las lesiones supuran o sangran.
- Si tienes preguntas o inquietudes sobre la queratosis actínica o cuidados.
¿Cómo se trata la queratosis actínica?
La mayoría de las queratosis actínicas se pueden tratar y curar con tratamientos físicos o tópicos (aplicados sobre la piel). En algunos casos, serán necesarios otros tipos de tratamiento. Las opciones incluyen1,23:
- Cremas o lociones tópicas (aplicadas directamente sobre la piel).
- Crioterapia (congela la lesión).
- Electrocauterización (quema la lesión con una corriente eléctrica).
- Peeling por láser.
- Terapia fotodinámica (se aplica un medicamento que se acumula en las células cancerosas y que solo se activa cuando la queratosis se ilumina con una luz láser especial).
- Extirpación o escisión quirúrgica.
El tipo de tratamiento depende del lugar, el número, el tamaño, y la gravedad de las lesiones. En algunos casos, se puede usar una combinación de métodos1.
Recursos en PDF para los pacientes
- Infografías y folletos para pacientes: Preguntas frecuentes sobre la queratosis actínica
- Infografías y folletos para pacientes: ¿Qué es la queratosis actínica?
Recursos en línea y apps para pacientes
El consejo del médico puede completarse recomendando webs y apps que sirvan a los pacientes para mejorar la información que tienen sobre su enfermedad, así como para apoyarlos en el cambio de los hábitos de vida.
Recursos relacionados
- Sección: Webs y apps para pacientes
- Blog: Redes sociales para médicos y para pacientes
- Blog: ¿Cómo usar las redes sociales para comunicarte con los pacientes?
Webs de dermatología para pacientes
La Academia Española de Dermatología y Venereología (AEDV) tiene una fundación asociada, la Fundación Piel Sana, dedicada a la difusión de conocimiento con información útil y actualizada para los pacientes. En esta plataforma encontramos las secciones Queratosis actínicas y Tratamientos tópicos para las queratosis actínicas.
American Academy of Dermatology (AAD)
La sección dedicada al paciente de la AAD es muy completa. La subsección Spot Skin Cancer contiene algunos recursos traducidos al español, vídeos y folletos. Hay una sección con imágenes e información básica llamada ¿Cómo se ve el cáncer de la piel? También dedica unas páginas específicamente a la queratosis actínica (en este caso, en inglés): síntomas, causas, tratamiento, etc.
La plataforma online de esta organización internacional dedicada a la educación, la prevención, la detección temprana y el tratamiento del cáncer de piel en todas sus variantes tiene una versión en español que contiene una sección sobre queratosis actínica. Toda la información está escrita y revisada por médicos.
Es el sitio web de la Biblioteca Nacional de Medicina de los Institutos Nacionales de Salud (NIH) americanos. Está dirigido a pacientes y sus familiares. Brinda información en español sobre enfermedades, condiciones y bienestar en un lenguaje asequible para todos los públicos. Se incluyen en su sitio web recursos didácticos para ayudar al paciente a entender mejor determinadas patologías. Contiene información específica sobre queratosis actínica.
Centros para el Control y la Prevención de Enfermedades (CDC)
En su página sobre el cáncer de piel, el CDC explica en español todo lo relacionado con el tema, incluida la forma de prevenirlo protegiéndose del sol.
El instituto nacional de cáncer de EE. UU. tiene una sección especial dedicada al cáncer de piel, con información dirigida tanto a médicos como a pacientes. Muchos de sus recursos se encuentran en español. Aquí puede encontrar información sobre la prevención y el tratamiento del cáncer de piel.
Apps de dermatología para pacientes
OddSpot
Esta app, promovida por la Technische Universiteit Eindhoven, pregunta al usuario acerca de la lesión en su piel para ayudarle a determinar la probabilidad de que esta sea queratosis actínica o un carcinoma de células escamosas. Afirma que su modelo predictivo se basa en investigaciones científicas de un gran número de lesiones y que esto les permite hacer las predicciones con fiabilidad. El resultado es un porcentaje de probabilidad asociado a QA y otro a CCE. También permite hacer una foto de la lesión que no se usará para la predicción, pero sí para futuras investigaciones.
Disponible en inglés para dispositivos con sistema Android.
Solmáforo App
Una app desarrollada por la Fundación Piel con Vida (México). Permite visualizar el índice de radiación ultravioleta en cualquier lugar del mundo, según el tipo de piel, los minutos de exposición al sol y el tipo de protección.
Disponible en español para dispositivos con sistema Android.
UV Derma
La Fundación Piel Sana de la Academia Española de Dermatología y Venereología ha desarrollado esta aplicación, que proporciona a la población general consejos para evitar los efectos nocivos del exceso de exposición solar.
Disponible en español para dispositivos con sistema Android e IOS.
eDerma
Aplicación gratuita que permite el seguimiento de las lesiones de la piel. El propio paciente realiza fotos de sus lesiones y la app las guarda de forma ordenada. De esta forma tanto el médico como el paciente pueden ver la evolución, y puede ayudar al paciente a decidir cuándo consultar. Dispone también de un servicio de alertas de la intensidad de la radiación ultravioleta. Está avalada por la Academia española de dermatología y venereología.
Se encuentra disponible en varios idiomas, incluido el español, en Android e IOS.
Bibliografía
- De Berker D, McGregor JM, Mohd Mustapa MF, Exton LS, Hughes BR. British Association of Dermatologists’ guidelines for the care of patients with actinic keratosis 2017. Br J Dermatol. 2017 Jan;176(1):20–43.
- Atkins D, Bang RH, Sternberg MR, Chen SC. Reliable methods to evaluate the burden of actinic keratoses. J Invest Dermatol. 2006;126(3):591-4.
- Warino L, Tusa M, Camacho F, Teuschler H, Fleischer AB, Feldman SR. Frequency and cost of actinic keratosis treatment. Dermatologic Surg. 2006;32(8):1045-9.
- Criscione VD, Weinstock MA, Naylor MF, Luque C, Eide MJ, Bingham SF. Actinic keratoses: Natural history and risk of malignant transformation in the veterans affairs topical tretinoin chemoprevention trial. Cancer. 2009;115(11):2523-30.
- Ferrándiz-Pulido C, Lera-Imbuluzqueta M, Ferrándiz C, Plazas-Fernandez MJ, on behalf to EPIQA Study Group. Prevalence of Actinic Keratosis in Different Regions of Spain: The EPIQA Study. Actas Dermosifiliogr (Engl Ed). 2018;109(1):83-86.
- Ferrándiz C, Plazas MJ, Sabaté M, Palomino R. Prevalencia de queratosis actínica en pacientes ambulatorios de dermatología en España. Actas Dermosifiliogr. 2016;107(8):674-80.
- Zagula‐Mally ZW, William Rosenberg E, Kashgarian M. Frequency of skin cancer and solar keratoses in a rural southern county as determined by population sampling. Cancer. 1974;34(2):345-9.
- Marks R, Jolley D, Lectsas S, Foley P. The role of childhood exposure to sunlight in the development of solar keratoses and non-melanocytic skin cancer. Med J Aust. 1990;152(2):62-6.
- Goldberg LH, Mamelak AJ. Review of actinic keratosis. Part I: etiology, epidemiology and clinical presentation. J Drugs Dermatol. 2010;9(9):1125-32.
- Flohil SC, Van Der Leest RJT, Dowlatshahi EA, Hofman A, De Vries E, Nijsten T. Prevalence of actinic keratosis and its risk factors in the general population: The Rotterdam study. J Invest Dermatol. 2013;133(8):1971-8.
- Cooper KD, Fox P, Neises G, Katz SI. Effects of ultraviolet radiation on human epidermal cell alloantigen presentation: Initial depression of Langerhans cell-dependent function is followed by the appearance of T6-Dr+cells that enhance epidermal alloantigen presentation. J Immunol. 1985;134(1):129-37.
- Leffell DJ. The scientific basis of skin cancer. J Am Acad Dermatol. 2000;42(1 Pt 2):18-22.
- Fu W, Cocherell CJ. The actinic (solar) keratosis: A 21st-century perspective. Arch Dermatol. 2003;139(1):66-70.
- Levine AJ, Momand J, Finlay CA. The p53 tumour suppressor gene. Nature. 1991;351(6326):453-456.
- Trakatelli M, Barkitzi K, Apap C, Majewski S, De Vries E, Coebergh JW, et al. Skin cancer risk in outdoor workers: A European multicenter case-control study. J Eur Acad Dermatology Venereol. 2016;30:5-11.
- Hensen P, Müller ML, Haschemi R, Ständer H, Luger TA, Sunderkötter C, et al. Predisposing factors of actinic keratosis in a North-West German population. Eur J Dermatology. 2009;19(4):345-54.
- Leslie D, Hart V. Skin cancer in a Queensland population. J Am Acad Dermatol. 1988;19(6):1045-52.
- Frost CA, Green AC, Williams GM. The prevalence and determinants of solar keratoses at a subtropical latitude (Queensland, Australia). Br J Dermatol. 1998;139(6):1033-9.
- Thompson SC, Jolley D, Marks R. Reduction of Solar Keratoses by Regular Sunscreen Use. N Engl J Med. 1993;329(16):1147-51.
- Madani S, Marwaha S, Dusendang JR, Alexeeff S, Pham N, Chen EH, et al. Ten-Year Follow-up of Persons with Sun-Damaged Skin Associated with Subsequent Development of Cutaneous Squamous Cell Carcinoma. JAMA Dermatology. 2021;157(5):559–65.
- Salasche SJ. Epidemiology of actinic keratoses and squamous cell carcinoma. J Am Acad Dermatol. 2000;42(1 Pt 2):4-7.
- McBride P, Neale R, Pandeya N, Green A. Sun-related factors, Betapapillomavirus, and actinic keratoses: A prospective study. Arch Dermatol. 2007;143(7):862-8.
- Ferrándiz C, Fonseca-Capdevila E, García-Diez A, Guillén-Barona C, Belinchón-Romero I, Redondo-Bellón P, et al. Adaptación española de la Guía europea para la evaluación y tratamiento de la queratosis actínica. Actas Dermosifiliogr. 2014;105:378-93.
- Cornejo CM, Jambusaria-Pahlajani A, Willenbrink TJ, Schmults CD, Arron ST, Ruiz ES. Field cancerization: Treatment. J Am Acad Dermatol. 2020;83(3):719–30.
- Chen QP, Aw DC. Epidemiology of skin diseases in renal transplant recipients in a tertiary hospital. Ann Acad Med Singapore. 2010;39(12):904-5.
- Keller B, Braathen LR, Marti HP, Hunger RE. Skin cancers in renal transplant recipients: A description of the renal transplant cohort in Bern. Swiss Med Wkly. Swiss Med Wkly. 2010;140:w13036.
- Del Rosso JQ. Current regimens and guideline implications for the treatment of actinic keratosis: proceedings of a clinical roundtable at the 2011 Winter Clinical Dermatology Conference. Cutis. 2011;88(1):1-8.
- Forslund O, Ly H, Reid C, Higgins G. A broad spectrum of human papillomavirus types is present in the skin of Australian patients with non-melanoma skin cancers and solar keratosis. Br J Dermatol. 2003;149(1):64-73.
- Dianzani C, Conforti C, Giuffrida R, Corneli P, di Meo N, Farinazzo E, et al. Current therapies for actinic keratosis. Int J Dermatol. 2020;59(6):677–84.
- Berman B, Bienstock L, Kuritzky L, Mayeaux EJ, Tyring SK. Actinic keratoses: sequelae and treatments. Recommendations from a consensus panel. J Fam Pract. 2006;55(5):1-8.
- Moy RL. Clinical presentation of actinic keratoses and squamous cell carcinoma. J Am Acad Dermatol. 2000;42(1):S8-10.
- Kuflik AS, Schwartz RA. Actinic keratosis and squamous cell carcinoma. Am Fam Physician. 1994;49(4):817-820.
- Hawrot A, Alam M RD. Squamous cell Carcinoma. Curr Probl Dermatol. 2003;15:91-133.
- Yu RCH, Pryce DW, MacFarlane AW, Stewart TW. A histopathological study of 643 cutaneous horns. Br J Dermatol. 1991;124(5):449-52.
- Heppt M V., Leiter U, Steeb T, Amaral T, Bauer A, Becker JC, et al. S3 guideline for actinic keratosis and cutaneous squamous cell carcinoma – short version, part 1: diagnosis, interventions for actinic keratoses, care structures and quality-of-care indicators. JDDG – J Ger Soc Dermatology. 2020;18(3):275–94.
- Werner RN, Stockfleth E, Connolly SM, Correia O, Erdmann R, Foley P, et al. Evidence- and consensus-based (S3) Guidelines for the Treatment of Actinic Keratosis – International League of Dermatological Societies in cooperation with the European Dermatology Forum – Short version. J Eur Acad Dermatol Venereol. 2015 Nov;29(11):2069-79.
- Dirschka T, Pellacani G, Micali G, et al. A proposed scoring system for assessing the severity of actinic keratosis on the head: actinic keratosis area and severity index. J Eur Acad Dermatol Venereol. 2017;31(8):1295-1302.
- Dominguez-Cruz J, Ruiz-Villaverde R. The ‘5R + R’ Rule: A simple and comprehensive method for diagnosis of actinic keratosis. Sultan Qaboos Univ Med J. 2019 Feb;19(1):e81-e82.
- Zalaudek I, Argenziano G. Dermoscopy of actinic keratosis, intraepidermal carcinoma and squamous cell carcinoma. Curr Probl Dermatol 2015; 46: 70–76.
- Akay BN, Kocyigit P, Heper AO, Erdem C. Dermatoscopy of flat pigmented facial lesions: Diagnostic challenge between pigmented actinic keratosis and lentigo maligna. Br J Dermatol. 2010 Dec;163(6):1212-7.
- Poulin Y, Lynde CW, Barber K, Vender R, Claveau J, Bourcier M, et al. Non-melanoma skin cancer in Canada chapter 3: Management of actinic keratoses. J Cutan Med Surg. 2015;19(3):227-38.
- O’Keefe R. Lever’s Histopathology of the Skin. Australas J Dermatol. 2005;46(4):286-286.
- Quaedvlieg PJ, Tirsi E, Thissen MR, Krekels GA. Actinic keratosis: how to differentiate the good from the bad ones?. Eur J Dermatol. 2006;16(4):335-339.
- Improving outcomes for people with skin tumours including melanoma : Evidence Update 25 May 2010. NHS Evid [Internet].Reino Unido; 2011 [citado 15 mar 2022];1-23 [aprox. 2 pantallas]. Disponible en: https://www.nice.org.uk/guidance/csg8
- Salido-Vallejo R, González-Velasco M, Guilabert M, García EI, Mira JJ. La percepción del proceso asistencial de pacientes con queratosis actínica. J Healthc Qual Res. 2018;33(6):360–9.
- NHS: National Health Service. Management of actinic keratosis in primary care [Internet]. Chelmsford (Reino Unido): NHS; 2015 [citado 14 mar 2022]; [6 p.]. Disponible en: https://www.clubdelafarmacia.com/wp-content/uploads/2018/06/ActinicKeratosisGUI201803v2.0-final.pdf
- Richard MA, Amici JM, Basset-Seguin N, Claudel JP, Cribier B, Dreno B. Management of actinic keratosis at specific body sites in patients at high risk of carcinoma lesions: expert consensus from the AKTeam™ of expert clinicians. J Eur Acad Dermatol Venereol. 2018;32(3):339-346.
- Naylor MF, Boyd A, Smith DW, Cameron GS, Hubbard D, Neldner KH. High Sun Protection Factor Sunscreens in the Suppression of Actinic Neoplasia. Arch Dermatol. 1995;131(2):170-5.
- Van Der Pols JC, Williams GM, Pandeya N, Logan V, Green AC. Prolonged prevention of squamous cell carcinoma of the skin by regular sunscreen use. Cancer Epidemiol Biomarkers Prev. 2006;15(12):2546-8.
- Ceilley RI, Jorizzo JL, Zografos P. Current issues in the management of actinic keratosis. J Am Acad Dermatol. 2013;68(1 Suppl 1):S28-S38.
- Cramer P, Stockfleth E. Actinic keratosis: where do we stand and where is the future going to take us? Expert Opin Emerg Drugs [Internet]. 2020;25(1):49–58.
- Gupta AK, Paquet M. Network meta-analysis of the outcome ‘participant complete clearance’ in non-immunosuppressed participants of eight interventions for actinic keratosis: a follow-up on a Cochrane review. Br J Dermatol 2013; 169:250–9.
- Jansen MHE, Kessels JPHM, Nelemans PJ, Kouloubis N, Arits AHMM, van Pelt HPA, et al. Randomized Trial of Four Treatment Approaches for Actinic Keratosis. N Engl J Med. 2019;380(10):935–46.
- Siegel J, Korgavkar K, Weinstock M. Current perspective on actinic keratosis: a review. Br J Dermatol. 2017;177:350-358.
- Dohil MA. Efficacy, Safety, and Tolerability of 4% 5-Fluorouracil Cream in a Novel Patented Aqueous Cream Containing Peanut Oil Once Daily Compared With 5% 5-Fluorouracil Cream Twice Daily: Meeting the Challenge in the Treatment of Actinic Keratosis. J Drugs Dermatol. 2016;15(10):1218-1224.
- Agencia española de medicamentos y productos sanitarios. Ficha técnica Tolak 40 mg/g crema [Internet]. Madrid; feb 2020 [citado 29 mar 2022]; [10 p.]. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/84849/84849_ft.pdf
- Stockfleth E, Kerl H, Zwingers T, Willers C. Low-dose 5-fluorouracil in combination with salicylic acid as a new lesion-directed option to treat topically actinic keratoses: histological and clinical study results. Br J Dermatol. 2011 Nov;165(5):1101-8.
- Eisen DB, Asgari MM, Bennett DD, Connolly SM, Dellavalle RP, Freeman EE, et al. Guidelines of care for the management of actinic keratosis. J Am Acad Dermatol. 2021;85(4):e209–33.
- De Oliveira ECV, Da Motta VRV, Pantoja PC, Ilha CS d. O, Magalhães RF, Galadari H, et al. Actinic keratosis – review for clinical practice. Int J Dermatol. 2019;58(4):400-407.
- Blauvelt A, Kempers S, Lain E, Schlesinger T, Tyring S, Forman S, et al. Phase 3 Trials of Tirbanibulin Ointment for Actinic Keratosis. N Engl J Med. 2021;384(6):512–20.
- Heppt MV, Dykukha I, Graziadio S, Salido-Vallejo R, Chapman-Rounds M, Edwards M. Comparative Efficacy and Safety of Tirbanibulin for Actinic Keratosis of the Face and Scalp in Europe: A Systematic Review and Network Meta-Analysis of Randomized Controlled Trials. J Clin Med. 2022;11(6):1654.
- Agencia Europea del Medicamento. Klisyri 10 mg/g pomada. Ficha técnica o resumen de las características del producto [Internet]. Amsterdam; 16 jul 2021 [citado 15 mar 2022]; [25 p.]. Disponible en: https://www.ema.europa.eu/en/documents/product-information/klisyri-epar-product-information_es.pdf
- Gilaberte Y, Fernández-Figueras MT. Tirbanibulina: revisión de su mecanismo de acción novedoso y de cómo encaja en el tratamiento de la queratosis actínica. Actas Dermosifiliogr. 2022;113(1):58–66.
- Agencia española de medicamentos y productos sanitarios. Ficha técnica Actikerall 5 mg/g +100 mg/g solución cutánea [Internet]. Madrid; oct 2020 [citado 15 mar 2022]; [9 p.]. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/77675/77675_ft.pdf
- Agencia española de medicamentos y productos sanitarios. Aldara 5% crema. Ficha técnica o resumen de las características del producto [Internet]. Madrid; 3 sep 2008 [citado 15 mar 2022]; [35 p.]. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/98080001/FT_98080001.pdf
- Agencia española de medicamentos y productos sanitarios. Zyclara 3,75% crema. Resumen de las características del producto [Internet]. Madrid; 22 mar 2017 [citado 15 mar 2022]; [28 p.]. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/12783002/FT_12783002.pdf
- Agencia española de medicamentos y productos sanitarios. Ficha ténica Solaraze 30 mg/g gel [Internet]. Madrid; ene 2021 [citado 15 mar 2022]; [8 p.]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/73714/FichaTecnica_73714.html
- Reynolds KA, Schlessinger DI, Vasic J, Iyengar S, Qaseem Y, Behshad R, et al. Core Outcome Set for Actinic Keratosis Clinical Trials. JAMA Dermatology. 2020;156(3):326–33.
- Gilaberte Y, Aguilar M, Almagro M, et al. Spanish-Portuguese consensus statement on use of daylight-mediated photodynamic therapy with methyl aminolevulinate in the treatment of actinic keratosis. Actas Dermosifiliogr. 2015;106(8):623-631.
- Basset-Seguin N, Braathen LR, Calzavara-Pinton P, Gilaberte Y, Haedersdal M, Hofbauer GF, et al. European Dermatology Forum Guidelines on Topical Photodynamic Therapy Updated version – 2019 [Internet].Berlín (Alemania); 2019 [citado 5 Mar 2022]. Available from: https://www.guidelines.edf.one//uploads/attachments/cl263q1jt00lulajn7foy5d7g-pdt-2019-gl.pdf
- Touma D, Yaar M, Whitehead S, Konnikov N, Gilchrest BA. A Trial of Short Incubation, Broad-Area Photodynamic Therapy for Facial Actinic Keratoses and Diffuse Photodamage. Arch Dermatol. 2004 Jan;140(1):33-40.
- Ianhez M, Fleury LFF, Miot HA, Bagatin E. Retinoids for prevention and treatment of actinic keratosis. An Bras Dermatol. 2013;88(4):585-593
- Jirakulaporn T, Endrizzi B, Lindgren B, Mathew J, Lee PK, Dudek AZ. Capecitabine for skin cancer prevention in solid organ transplant recipients. Clin Transplant. 2011;25(4):541-8.
- Elmets CA, Viner JL, Pentland AP, Cantrell W, Lin HY, Bailey H, et al. Chemoprevention of nonmelanoma skin cancer with celecoxib: A randomized, double-blind, placebo-controlled trial. J Natl Cancer Inst. 2010;102(24):1835-44.
- Liebman TN, Stein JA, Polsky D. Cyclo-oxygenase-2 inhibitors for chemoprevention of nonmelanoma skin cancer: Is there a role for these agents? J Am Acad Dermatol. 2013;68(1):173-176.
- Gupta AK, Paquet M, Villanueva E, Brintnell W. Interventions for actinic keratoses. Cochrane Database Syst Rev. 2012;12(12):CD004415.
- Heppt M V., Steeb T, Leiter U, Berking C. Efficacy of photodynamic therapy combined with topical interventions for the treatment of actinic keratosis: a meta-analysis. J Eur Acad Dermatology Venereol. 2019 May 1;33(5):863-73.
- Mastrolonardo M. Topical diclofenac 3% gel plus cryotherapy for treatment of multiple and recurrent actinic keratoses. Clin Exp Dermatol. 2009;34(1):33-5.
- Tan JKL, Thomas DR, Poulin Y, Maddin F, Tang J. Efficacy of imiquimod as an adjunct to cryotherapy for actinic keratoses. J Cutan Med Surg. 2007 Nov;11(6):195-201.
- Steeb T, Wessely A, Petzold A, Brinker TJ, Schmitz L, Leiter U, et al. Evaluation of Long-term Clearance Rates of Interventions for Actinic Keratosis: A Systematic Review and Network Meta-analysis. JAMA Dermatology. 2021;157(9):1066–77.
- Jansen MHE, Kessels JPHM, Merks I, Nelemans PJ, Kelleners-Smeets NWJ, Mosterd K, et al. A trial-based cost-effectiveness analysis of topical 5-fluorouracil vs. imiquimod vs. ingenol mebutate vs. methyl aminolaevulinate conventional photodynamic therapy for the treatment of actinic keratosis in the head and neck area performed in the Netherla. Br J Dermatol. 2020;183(4):738–44.
- Schmitz L, Brehmer A, Falkenberg C, Gambichler T, Heppt M V., Steeb T, et al. Treatment-resistant actinic keratoses are characterized by distinct clinical and histological features. Ital J Dermatology Venereol. 2021;156(2):213–9.
- Ferrándiz-Pulido C. Actualización en cáncer de piel en receptores de un trasplante de órgano sólido. Nefrologia Sup Ext. 2018;9(1):6-20.
- Liew YCC, De Souza NNA, Sultana RG, Oh CC. Photodynamic therapy for the prevention and treatment of actinic keratosis/squamous cell carcinoma in solid organ transplant recipients: a systematic review and meta-analysis. J Eur Acad Dermatology Venereol. 2020;34(2):251–9.
- Fuchs A, Marmur E. The kinetics of skin cancer: Progression of actinic keratosis to squamous cell carcinoma. Dermatologic Surg. 2007;33(9):1099-101.
- Marks R, Rennie G, Selwood TS. Malignant transformation of solar keratoses to squamous cell carcinoma. Lancet. 1988;331(8589):795-7.
- Marks R, Foley P, Goodman G, Hage BH, Selwood TS. Spontaneous remission of solar keratoses: the case for conservative management. Br J Dermatol. 1986;115(6):649-55.
- Werner RN, Sammain A, Erdmann R, Hartmann V, Stockfleth E, Nast A. The natural history of actinic keratosis: a systematic review. Br J Dermatol. 2013;169(3):502-518.
- Kwa RE, Campana K, Moy RL. Biology of cutaneous squamous cell carcinoma. J Am Acad Dermatol. 1992;26(1):1-26.
- Marks R, Rennie G, Selwood T. The Relationship of Basal Cell Carcinomas and Squamous Cell Carcinomas to Solar Keratoses. Arch Dermatol. 1988;124(7):1039-42.
- Lee JH, Kim YH, Han K Do, Park YM, Lee JY, Park YG, et al. Incidence of actinic keratosis and risk of skin cancer in subjects with actinic keratosis: A population-based cohort study. Acta Derm Venereol. 2018;98(3):382-3.
- Rigel DS. Photoprotection: A 21st century perspective. Br J Dermatol. 2002;146 Suppl 61:34-37.