Patología
¿Qué es la esclerosis múltiple?
La esclerosis múltiple (EM) es una enfermedad del sistema nervioso central (SNC) que se caracteriza por inflamación, desmielinización y cambios degenerativos. Se trata de una patología crónica en la que aparecen áreas multifocales de desmielinización con pérdida de oligodendrocitos y cicatrización astroglial, además de lesión axonal (especialmente, en etapas avanzadas)1.
Aunque su causa es desconocida, se cree que la inflamación aguda es secundaria a una respuesta inmunitaria alterada ante ciertos desencadenantes ambientales en personas con predisposición genética (principalmente con variaciones en el locus HLA-DRB1)2. Entre los factores ambientales que podrían jugar un papel en la esclerosis múltiple están los siguientes3:
- Infecciones víricas: aunque no está claro, las infecciones por el virus de la hepatitis B, el virus de Epstein-Barr y el virus de la varicela podrían ser factores desencadenantes de la EM.
- Factores geográficos: existe una clara variabilidad geográfica en cuanto a la incidencia y prevalencia de la EM. Las áreas de mayor prevalencia son Europa, el sur de Canadá, el norte de Estados Unidos, Nueva Zelanda y el sur de Australia. Existe una clara relación entre la latitud y la prevalencia de EM, que aumenta de sur a norte.
- Exposición solar y vitamina D: se ha encontrado una relación inversa entre la exposición solar y los niveles de vitamina D, y la prevalencia de esclerosis múltiple, lo cual podría explicar parte de la variabilidad geográfica.
- Otros: parece que el tabaco aumenta el riesgo de EM, así como la obesidad en la infancia y adolescencia. Por el contrario, no se ha encontrado una asociación entre las vacunas y la aparición de EM.
La EM afecta más mujeres que a hombres (de 2 a 3 veces más) y generalmente comienza entre los 20 y 40 años, de forma que su aparición es excepcional más allá de la séptima década de vida1.
La EM puede llegar a ser un trastorno muy incapacitante; de hecho, constituye la causa más frecuente de discapacidad no traumática en la población adulta joven1. Además, la EM puede conllevar un impacto considerable a nivel social y económico, ya que su carácter crónico y debilitante limita la calidad de vida de los pacientes y de sus familias. Algunos de sus síntomas más frecuentes, como la espasticidad, contribuyen a aumentar este impacto negativo sobre el bienestar personal y la calidad de vida de los pacientes con EM, al afectar la deambulación, interferir con las actividades de la vida diaria y exacerbar la fatiga4.
¿Cuáles son sus manifestaciones clínicas?
La EM es una enfermedad heterogénea con manifestaciones clínicas diversas y con una amplia variabilidad interindividual5,6, por lo que no hay síntomas que sean exclusivos. No obstante, en general, los síntomas y signos que se observan con más frecuencia en pacientes con EM incluyen los siguientes:
- Alteraciones de la sensibilidad en las extremidades o en un lado de la cara. Casi todos los pacientes las presentarán en algún momento de la enfermedad. Lo describen como hormigueos, acorchamiento, pinchazos, tirantez, sensación de hinchazón… La neuralgia del trigémino en un paciente joven puede ser el debut de una EM5.
- Pérdida visual. La neuritis óptica suele presentarse como dolor ocular unilateral que se acrecienta con los movimientos del ojo y pérdida visual, sobre todo, central. El 90 % de los pacientes recupera la visión a los 2-6 meses de un episodio de neuritis óptica5.
- Fatiga: es un síntoma común (86 %), que suele expresarse como agotamiento físico independiente de la cantidad de actividad que se haga. Empeora a lo largo del día, con la humedad y con el calor, e interfiere en las actividades de la vida diaria5.
- Espasticidad. Afecta al 40 %-84 %4,7 de los pacientes con EM y es un síntoma muy discapacitante. Aparece como consecuencia de una pérdida del control de los reflejos medulares y suele evolucionar hacia la cronicidad7. Se caracteriza por un aumento del tono muscular, de predominio en miembros inferiores, que produce rigidez y espasmos (que pueden ser dolorosos) y limita la movilidad. Además, la espasticidad se asocia a otros síntomas, como disfunción vesical, alteraciones del sueño y fatiga, lo cual empeora aún más la calidad de vida y limita las actividades de la vida diaria4,7.
- Alteraciones cognitivas. Aunque la demencia franca es poco frecuente y se ve en etapas muy avanzadas de la EM, alrededor del 70 % de los pacientes tienen algún tipo de alteración cognitiva. Las más frecuentes son las alteraciones de la atención, las funciones ejecutivas, la memoria a corto plazo, la evocación de palabras y la velocidad de procesamiento de la información5.
- Debilidad motora aguda o subaguda. La paraparesia o la paraplejia son más frecuentes que la debilidad aislada de las extremidades superiores5.
- Alteraciones de los movimientos oculares. Son muy comunes las alteraciones de la mirada voluntaria, como la oftalmoplejía internuclear (al intentar el paciente mirar hacia un lado, se observa una paresia de la aducción del ojo ipsilateral y un nistagmo horizontal del ojo contralateral; se debe a la lesión de la cintilla longitudinal posterior).
El nistagmo también es muy frecuente. Puede ser tanto horizontal como vertical, y es muy típico el pendular (la mayoría de los pacientes con este tipo de nistagmo tienen EM).
Las alteraciones de los movimientos oculares pueden producir diplopía y oscilopsia (sensación subjetiva de oscilación o movimiento en vaivén de los objetos)5.
- Alteraciones de la marcha, el equilibrio y el habla. La afectación de las vías cerebelosas puede producir desequilibrio en la marcha, dificultad para coordinar los brazos y las manos y disartria. También es frecuente (45 % de los pacientes) el temblor5.
- Síntomas paroxísticos. Puede haber crisis paroxísticas de naturaleza motora o sensitiva. Por ejemplo, el signo de L´Hermitte es una sensación de descarga eléctrica que baja por la espalda y/o los miembros al flexionar el cuello; es muy típico —pero no patognomónico— de la EM5.
- Vértigo. Le ocurre al 30-50 % de los pacientes con EM. La forma más frecuente es el vértigo posicional paroxístico benigno5.
- Problemas urinarios. Afectan hasta al 75 % de los pacientes con EM. El síntoma más frecuente es la urgencia. La incontinencia urinaria es más frecuente a medida que la enfermedad progresa. Los mecanismos que subyacen a la disfunción vesical neurógena de la EM son variados, pero las consecuencias suelen ser dificultades bien en el vaciado, bien en el almacenamiento de la orina. Pueden coexistir diversas alteraciones5.
- Problemas intestinales. Alrededor del 50 % de los pacientes con EM presentan alteraciones de la función intestinal, como estreñimiento o incontinencia fecal5.
- Alteraciones del sueño. Son frecuentes el insomnio (tanto de conciliación como de mantenimiento), el síndrome de piernas inquietas y el síndrome de apnea obstructiva del sueño, entre otros. Los espasmos por la epasticidad, el dolor y la nicturia con frecuencia interrumpen el sueño de los pacientes con EM4,5.
- Disfunción sexual. En los hombres, lo más frecuente es la disminución de la libido, la disfunción eréctil, la eyaculación precoz, la disfunción orgásmica y la reducción de la sensibilidad en el pene. Las mujeres presentan disminución de la libido, dificultad para alcanzar el orgasmo, descenso de la lubricación y la sensibilidad vaginal y dispareunia. Alrededor del 50 % de las personas con EM dejan de tener relaciones sexuales debido a la enfermedad5.
- Dolor. Un metanálisis con 7000 pacientes encontró que el 63 % de los pacientes con EM sufre algún tipo de dolor: cefalea, dolor neuropático, dolor paroxístico, dolor de espalda, espasmos dolorosos, neuralgia del trigémino, etc5.
- Hipersensibilidad al calor (fenómeno de Uhthoff). Pequeños incrementos de la temperatura corporal pueden empeorar transitoriamente síntomas y signos actuales o preexistentes. Les ocurre al 60 %-80 % de los pacientes5.
- Depresión. Hasta dos tercios de los pacientes con EM presentan algún grado de trastorno afectivo. La fatiga, el dolor, la ansiedad, el abuso de sustancias y el deterioro cognitivo son algunos de los factores que contribuyen a la depresión. Asimismo, la depresión empeora las funciones cognitivas5.
¿Qué tipos de pacientes hay con esclerosis múltiple?
Clasificación fenotípica
Atendiendo al fenotipo de la enfermedad, la EM se clasifica en6:
- Síndrome clínico aislado (clinically isolated síndrome, CIS). Constituye el primer episodio clínico sugestivo de EM y se presenta como un episodio clínico monofásico con signos y síntomas que reflejan un evento desmielinizante inflamatorio en el SNC (focal o multifocal). Este episodio se desarrolla de forma aguda o subaguda y tiene una duración de al menos 24 horas, con o sin recuperación, en ausencia de fiebre o infección6,8,9.
Aunque las manifestaciones clínicas específicas de este síndrome dependen de la localización anatómica de la lesión o lesiones, las presentaciones típicas incluyen las siguientes9:
- neuritis óptica unilateral;
- diplopía no dolorosa secundaria a oftalmoplejía internuclear, con frecuencia bilateral;
- síndrome supratentorial focal, troncoencefálico o cerebeloso;
- mielitis transversa parcial, por lo general con predominio de síntomas sensitivos, incluido el síndrome de Brown-Sequard parcial y el signo de L´Hermitte.
- EM recurrente-remitente (EMRR). Representa el patrón más común de EM, pues afecta al 85 %-90% de los pacientes al inicio9,10. Cursa de forma característica con crisis claramente definidas (también conocidas como recaídas o exacerbaciones), con recuperación completa o incompleta entre los episodios. La discapacidad neurológica entre los episodios es estable9.
Las recaídas pueden presentarse con cualquiera de las manifestaciones clínicas típicas de la EM, sin que existan características clínicas específicas que nos ayuden a distinguir de forma certera el episodio clínico inicial de la EM de una recaída. Asimismo, el primer episodio se presenta como un síndrome clínico aislado, aunque es posible ya diagnosticarlo como EM con un único episodio si en la resonancia magnética se aprecian de forma simultánea lesiones captantes y no captantes de gadolinio9.
Los síntomas y signos asociados a la recaída suelen alcanzar su intensidad máxima en días o semanas y van seguidos de una fase de remisión durante la cual los síntomas se resuelven en un grado variable. No obstante, la progresión de la enfermedad durante los episodios es mínima, aunque la recaída en sí misma puede suponer una discapacidad residual grave6,9.
- EM progresiva primaria (EMPP): supone alrededor del 10 % de los casos de EM al inicio y se caracteriza por la acumulación progresiva de discapacidad desde el comienzo de la enfermedad, con mesetas ocasionales, pequeñas mejoras temporales o nuevas recaídas9.
A diferencia de la EMRR, este tipo de EM afecta por igual a hombres y mujeres y su edad media de aparición es más tardía, a los 40 años, 10 años más tarde que la edad media de presentación de la EMRR.
La presentación clínica más frecuente es un síndrome de médula espinal que empeora durante meses o años, con paraparesia espástica asimétrica y sin un claro nivel sensorial. Otra manifestación clínica menos frecuente es la ataxia cerebelosa progresiva; los síntomas cognitivos, del tronco encefálico o visuales son muy raros9,10.
El diagnóstico de la EMPP se basa en la historia del paciente, ya que no existe ninguna exploración física ni prueba de imagen que la distinga de la forma recurrente-remitente. El pronóstico de discapacidad a largo plazo en estos pacientes es peor en comparación con los pacientes con EMRR9,10.
- EM progresiva secundaria (EMPS): se caracteriza por un curso inicial de tipo recurrente-remitente seguido de un empeoramiento gradual, ya sea con o sin recaídas ocasionales, remisiones menores y mesetas. Sin embargo, no hay criterios establecidos para determinar cuándo la EMRR se convierte en EMPS; de hecho, el diagnóstico es retrospectivo. La transición entre ambas suele aparecer de 10 a 20 años tras el inicio de la enfermedad9.
A su vez, estos subtipos de enfermedad se pueden clasificar en activos o no, según si hay recaída clínica reciente o actividad de la lesión en las imágenes por resonancia magnética, así como en progresivos o no progresivos, en función de la evaluación clínica de la discapacidad8,9.
Diagnóstico
¿Qué hacer con un paciente con sospecha de EM?
La evaluación de un paciente en el que se sospecha EM debe comenzar por una anamnesis y una exploración física exhaustivas11.
La anamnesis debe enfocarse en conocer la existencia de crisis previas con los síntomas y evolución característicos de una desmielinización inflamatoria en el SNC8,11,12. La presencia de episodios clínicos reversibles con una exploración física congruente o la presencia de dos brotes con lesiones en dos áreas diferentes del SNC nos harán sospechar una posible EM. De hecho, el paciente típico con EM se presenta como un adulto joven con uno o más episodios clínicamente distintos de disfunción del SNC que se desarrollan en horas o días, seguido de una remisión gradual durante las semanas o meses siguientes, si bien esta remisión puede ser incompleta8,11.
La exploración neurológica irá encaminada a revelar signos de episodios desmielinizantes en el SNC, tanto previos como actuales. De esta forma, buscaremos defectos pupilares aferentes o pérdida visual (neuritis óptica), oftalmoplejía internuclear, nistagmo pendular, signos de neurona motora superior (como espasticidad, hiperreflexia, signo de Babinski), ataxia, alteración de la marcha, pérdida sensorial uni o bilateral y/o parestesias en las extremidades6,11,13.
Pruebas de laboratorio
La determinación de anticuerpos antinucleares, vitamina B12 y función tiroidea6,14, acompañada —según sospecha— de estudios serológicos para la sífilis y el virus de la inmunodeficiencia humana (VIH), puede constituir una buena batería estándar para el diagnóstico de EM14.
Además, dependiendo de la presentación clínica, puede estar también indicada la realización de otras pruebas de laboratorio, como la serología del virus linfotrópico de células T humanas 1 y 2 o la detección de anticuerpos antiacuaporina-4 y antimielina de glucoproteína de oligodendrocitos14. Estos autoanticuerpos están indicados en pacientes que presentan desmielinización aguda del SNC y el cuadro clínico, las pruebas de imagen o los resultados de laboratorio no son típicos de EM11.
Pruebas de imagen
La resonancia magnética (RM) cerebral es la prueba de imagen más sensible, puesto que permite detectar placas desmielinizantes y ayuda a descartar otras patologías que podrían dar clínica similar. Por ello, es la herramienta más útil en el diagnóstico y seguimiento de los pacientes con EM15, y todo paciente con un cuadro clínico que sugiera un primer brote de origen desmielinizante debe someterse a esta prueba de imagen1,6,16.
Las lesiones de RM sugerentes de EM (Figura 1) suelen tener una apariencia ovoidal y un diámetro >3 mm, y con frecuencia se localizan en áreas concretas de la sustancia blanca: región periventricular, cuerpo calloso, centro semioval y, en menor medida, estructuras profundas de la sustancia blanca y los ganglios basales11.
En imágenes de corte sagital, la disposición característica de estas lesiones es en ángulo recto con respecto al cuerpo calloso; se conocen como dedos de Dawson11.
Las lesiones cerebrales de la EM son hiperintensas en secuencias de densidad protónica y en las imágenes ponderadas en T2, y son hipointensas («agujeros negros») o incluso invisibles en las imágenes ponderadas en T1, sobre todo en EM de larga evolución11,15.
Por su parte, las lesiones activas tienen a ser más grandes y con bordes mal definidos. A medida que se resuelven, se hacen más pequeñas y con los bordes más definidos. Esto se debe a la reducción del edema y la inflamación presentes cuando se instaura la lesión11.
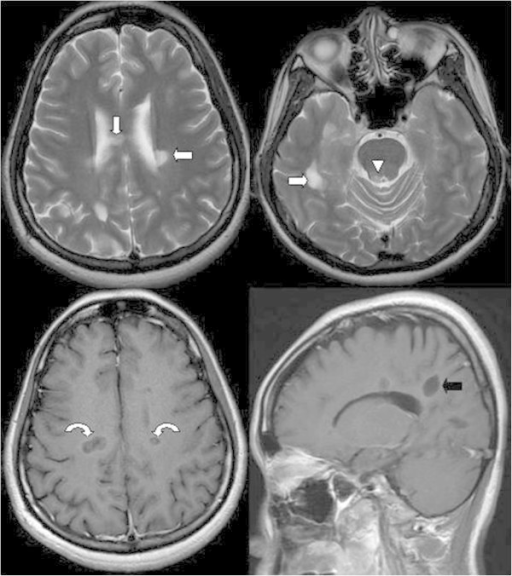
Figura 1. RMN cerebral de un paciente con esclerosis múltiple
En la imagen ponderada en T2 se aprecian lesiones hiperintensas en la sustancia blanca periventricular bilateral (flecha blanca), cuerpo calloso (flecha blanca) y sustancia gris periacueductal (punta de flecha). Tras la inyección de gadolinio, en la imagen ponderada en T1 se observa realce en anillo en estas lesiones (flechas curvas), lo cual sugiere la existencia de desmielinización activa. En el corte sagital, se ven lesiones de esclerosis múltiple con la típica orientación perpendicular al cuerpo calloso (dedos de Dawson) (flecha negra).
Fuente: Lin GY, Wang CW, Chiang TT, Peng GS, Yang FC. Multiple sclerosis presenting initially with a worsening of migraine symptoms. J Headache Pain. 2013; 14(1): 70. Licencia CC BY 2.0.
Más del 90 % de los pacientes con EM presentan problemas en la médula espinal17, por lo que la RM medular (especialmente del segmento cervical) está indicada en los casos en los que los hallazgos de la RM cerebral no son concluyentes o el cuadro se inicia con un síndrome medular6. La RMN de la médula espinal puede aumentar la probabilidad de encontrar lesiones diseminadas en el espacio y la sensibilidad diagnóstica, en comparación con la RMN cerebral aislada11.
Las imágenes obtenidas por RM también permiten estudiar la diseminación en espacio (disemination in space, DIS) y diseminación en tiempo (disemination in time, DIT) de la enfermedad, en ausencia de una mejor explicación12 (Tabla 1), lo cual —como veremos más adelante— constituye uno de los criterios diagnósticos de EM.
Tabla 1. Criterios de McDonald de 2017 para la demostración de diseminación en espacio y tiempo por RM en pacientes con síndrome clínico aislado
| · La diseminación en espacio puede demostrarse por una o más lesiones hiperintensas en T2* características de la esclerosis múltiple en dos o más de las cuatro áreas del SNC: periventricular†, cortical o yuxtacortical, infratentorial y médula espinal.
· La diseminación en tiempo puede demostrarse por la presencia simultánea de lesiones captantes y no captantes* de gadolinio en cualquier momento o por la aparición durante el seguimiento de una nueva lesión hiperintensa en T2 o captante de gadolinio, con referencia a una prueba de imagen basal, independientemente del momento de la RMN basal. |
| *A diferencia de los criterios de McDonald de 2010, en la RM no se establece distinción entre lesiones sintomáticas y asintomáticas.
† Para algunos pacientes —por ejemplo, personas mayores de 50 años o aquellos con factores de riesgo vascular— podría ser prudente para el clínico buscar un número mayor de lesiones periventriculares. |
Fuente: Guía para el manejo del paciente con Esclerosis Múltiple6
En algunos casos (el 0,8 por 100 000 habitantes)18, durante el estudio por RM puede detectarse un síndrome aislado radiográficamente. Este síndrome hace referencia a la presencia de lesiones en la RM características de EM, pero que no se acompañan de manifestaciones neurológicas u otra explicación clara8. De hecho, las lesiones a menudo se descubren incidentalmente en la RM durante el estudio diagnóstico de otras afecciones (por ejemplo, cefalea o lesión craneoencefálica)11.
Otras pruebas complementarias
En pacientes en los que la EM se presenta de forma típica, pero la clínica y el estudio por RM son insuficientes para confirmar el diagnóstico según los criterios de McDonald, se pueden utilizar otras pruebas complementarias para apoyar el diagnóstico. Estas pruebas son:
- Punción lumbar. Sirve para detectar bandas oligoclonales específicas, que pueden estar presentes en el líquido cefalorraquídeo (LCR) hasta en el 95 % de los pacientes con EM clínicamente definida11,19. El estudio del LCR se considera positivo cuando se detectan bandas oligoclonales diferentes a las presentes en el suero, o un aumento del índice de inmunoglobulina G (IgG). Sin embargo, la presencia de bandas oligoclonales no siempre equivale al diagnóstico de EM, ya que el riesgo de falsos positivos es alto y es una prueba sujeta a gran variabilidad, tanto en la técnica utilizada como en la interpretación en diferentes laboratorios11.
- Estudios neurofisiológicos. Los potenciales evocados son las manifestaciones eléctricas que se generan en el SNC por la estimulación periférica de un órgano sensorial. Los potenciales evocados, especialmente los visuales, se utilizan en pacientes sin manifestaciones clínicas aparentes para identificar disfunción neurológica visual, del tronco encefálico y de la médula espinal8. Los pacientes con EM suelen mostrar un aumento de la latencia y una disminución de la amplitud de la respuesta, con asimetrías20.
- Tomografía de coherencia óptica (optical coherence tomography, OCT). Se trata de un procedimiento no invasivo para obtener imágenes de la retina en alta resolución. Permite detectar reducciones del grosor de la capa de fibra nerviosa de la retina, que afectan hasta al 85 % de los pacientes con neuritis óptica21. Aunque el papel de esta prueba en el diagnóstico de la EM aún no está claro21, sí que puede resultar útil en pacientes que tienen antecedentes compatibles con neuritis óptica y en los que la exploración y las pruebas de imagen cerebral son normales22.
¿Cómo se diagnostica?
Para hacer el diagnóstico de EM, es fundamental que un médico con experiencia integre la historia clínica, la exploración física, las pruebas de imagen y los resultados de las pruebas de laboratorio8.
Criterios de McDonald 2017
El diagnóstico definitivo de la EM se basa en los criterios de McDonald y precisa demostrar la diseminación de las lesiones desminelinizantes en el SNC tanto en el tiempo como en el espacio, bien a partir de datos clínicos por sí solos, bien a partir de una combinación de hallazgos clínicos y de resonancia magnética. Estos criterios se han revisado en 2005, 2010 y, más recientemente, en 20176, y tienen como objetivo llegar al diagnóstico temprano de EM, sin que exista una posibilidad diagnóstica mejor2.
Los criterios de McDonald se aplican principalmente a pacientes que tienen un síndrome clínicamente aislado típico con presentación sugestiva de EMRR (Tabla 2), aunque también se pueden utilizar en pacientes que presentan progresión neurológica insidiosa sugestiva de EMPP (Tabla 3).
Tabla 2. Criterios de McDonald 2017 para el diagnóstico de esclerosis múltiple en pacientes con un brote típico / síndrome clínicamente aislado al debut
| Presentación
clínica |
Número de lesiones con
evidencia clínica objetiva |
Datos adicionales necesarios para el
diagnóstico de esclerosis múltiple |
| ≥2 brotes clínicos
|
≥2 | Ninguno* |
| 1 (así como antecedentes claros de un ataque previo con una lesión en una posición anatómica distinta)** |
Ninguno* |
|
|
1 |
La diseminación en el espacio debe demostrarse mediante otro brote clínico que afecte a un área diferente del SNC o mediante RM. | |
|
1 brote clínico
|
≥2 |
La diseminación en el tiempo debe demostrarse mediante otro brote clínico o mediante RM o mediante la presencia de bandas oligoclonales específicas del LCR. |
|
1 |
La diseminación en el espacio debe demostrarse mediante otro brote clínico que afecte a un área diferente del SNC o mediante RM
Y la diseminación en el tiempo debe demostrarse mediante otro ataque clínico o mediante RM o mediante la presencia de bandas oligoclonales específicas del LCR***. |
|
| Si los criterios de McDonald 2017 se cumplen y no hay mejor explicación para la presentación clínica, el diagnóstico es «esclerosis múltiple».
Si se sospecha esclerosis múltiple en virtud de un síndrome clínico aislado, pero los criterios de McDonald 2017 no se cumplen por completo, el diagnóstico es «posible esclerosis múltiple». Si durante la evaluación surge otro diagnóstico que explique mejor la presentación clínica, el diagnóstico no es esclerosis múltiple. * No se requieren exámenes adicionales para demostrar la diseminación en el espacio y el tiempo. Sin embargo, a menos que no sea posible, debe obtenerse una resonancia magnética cerebral en todos los pacientes en quienes se sospeche esclerosis múltiple. Además, debe valorarse hacer una RM de la médula espinal o un análisis del LCR a los pacientes con datos clínicos insuficientes y RM sugerente de esclerosis múltiple, o que tengan una presentación distinta de un síndrome clínico aislado típico o que muestren características atípicas. Si las pruebas de imagen u otras pruebas (por ejemplo, el análisis del LCR) son negativas, deben tomarse precauciones antes de diagnosticar esclerosis múltiple, y deberán considerarse diagnósticos alternativos. ** El diagnóstico clínico basado en datos clínicos objetivos de dos brotes es más seguro. Los antecedentes razonables de un brote previo, en ausencia de datos neurológicos objetivos, pueden incluir episodios previos con síntomas y evolución característicos de un brote desmielinizante inflamatorio; sin embargo, al menos uno de los ataques debe ser respaldado por datos objetivos. En ausencia de datos objetivos residuales, es preciso actuar con cautela. *** La presencia de bandas oligoclonales específicas del LCR no demuestra per se diseminación en el tiempo, pero puede sustituir el requisito para demostrar este tipo de diseminación. |
||
Fuente: Olek, et al.11
Tabla 3. Criterios de McDonald 2017 para el diagnóstico de esclerosis múltiple en pacientes con progresión desde el debut (esclerosis múltiple primaria progresiva)
La esclerosis múltiple primaria progresiva puede diagnosticarse en pacientes con 1 año de progresión de la discapacidad (determinado retrospectiva o prospectivamente), independientemente de la recurrencia clínica, Y DOS de los siguientes criterios:
|
| A diferencia de los criterios de McDonald de 2010, en la RM no se hace distinción entre las lesiones sintomáticas y asintomáticas. |
Fuente: Olek, et al.11
Diagnóstico diferencial
A pesar de que estos criterios diagnósticos son útiles ante la sospecha clínica de EM, no diferencian la EM de otras afecciones neurológicas. El diagnóstico diferencial de la EM incluye una serie de trastornos inflamatorios, vasculares, infecciosos, genéticos, granulomatosos y desmielinizantes, y depende del contexto clínico. La identificación de signos que no apoyan el diagnóstico de EM, como los recogidos en la Tabla 4, nos pueden alertar sobre la posibilidad de que estemos ante un diagnóstico alternativo al de EM y de la necesidad de replantearnos el diagnóstico.
Tabla 4. Signos que no apoyan el diagnóstico de esclerosis múltiple
| Presentaciones clínicas |
| • Sin difusión en el tiempo/espacio
• Inicio en personas <10 o >55 años • Fiebre/cefalea prominente, deterioro de la conciencia • Pérdida auditiva brusca • Defecto de campo no escotomatoso • Características corticales (convulsiones, afasia, ceguera cortical) • Encefalopatía |
| Neuritis óptica |
| • Presentación bilateral
• Dolor intenso que restringe el movimiento o despierta al paciente • Pérdida visual muy grave sin recuperación después de 1 mes • Uveítis • Exudados o hemorragias retinianas, edema intenso del disco óptico y reacción vítrea • Antecedentes de cáncer |
| Mielitis transversa |
| • Inicio hiperagudo no progresivo
• Participación completa del segmento espinal • Mielopatía progresiva en ausencia de afectación vesical • Arteria espinal de distribución anterior • Dolor radicular • Síndrome de la cola de caballo • Signos coexistentes de neurona motora inferior |
| Tronco encefálico / cerebeloso |
| • Inicio hiperagudo en un territorio vascular
• Síntomas oculares o bulbares fatigables o fluctuantes |
| Oftalmoplejía externa completa |
| Resonancia magnética |
| • Cerebro: normal; lesiones pequeñas <3 mm; afectación prominente de la materia gris; hidrocefalia; ausencia de lesiones callosas o periventriculares; lesiones de la sustancia blanca simétricas y confluentes; realce meníngeo o realce simultáneo de todas las lesiones
• Columna vertebral: lesión extensa que abarca 3 o más segmentos, inflamación, lesiones de grosor completo, realce leptomeníngeo o lesiones hipointensas en T1 |
| LCR |
| • Normal
• Ausencia de bandas oligoclonales (por técnica de enfoque isoeléctrico) • Recuento de glóbulos blancos >50 • Proteínas >80 mg/dl |
Fuente: Traboulsee, et al.16
Valoración de la espasticidad
Una vez realizado el diagnóstico de EM, se deben valorar los síntomas concretos, como la espasticidad.
La espasticidad se manifiesta como rigidez continua con posibles exacerbaciones y espasmos en flexión o extensión, a veces dolorosos. Puede causar dolor, trastornos de la marcha, trastornos esfinterianos (que afectan notablemente a la calidad de vida) y alteración de algunos movimientos, lo cual disminuye la calidad de vida y puede causar una discapacidad importante7. Además, afecta al sueño, se asocia a fatiga y aumenta el riesgo de úlceras por presión4.
La espasticidad puede localizarse en un único grupo muscular (espasticidad focal) o ser generalizada. Se afectan con más frecuencia las extremidades inferiores que las superiores o el tronco. La postura anómala que con más frecuencia afecta a las extremidades inferiores es la combinación de extensión, aducción y rotación interna7.
Para diagnosticar la espasticidad, debe hacerse una anamnesis detallada, preguntando al paciente si tienen rigidez y espasmos (por ejemplo, nocturnos).
En la exploración neurológica debe inspeccionarse la marcha y buscarse signos como7:
- resistencia al movimiento pasivo de los miembros, que aumenta al moverlos más rápido;
- espasmos flexores, extensores y aductores;
- hiperactividad de los reflejos tendinosos;
- reflejo cutaneoplantar en extensión o clono aquíleo;
- contracción simultánea de los grupos musculares antagonistas.
Existen diversas escalas para valorar el grado de espasticidad. No existe un consenso para determinar qué escala usar, pero una buena opción es utilizar 3 escalas que se complementan entre sí7:
- Escala de Ashworth modificada (Tabla 5). Mide el tono muscular y el rango de movimiento de las extremidades. Es un sistema de puntuación subjetiva que oscila desde el grado 0 (sin aumento del tono muscular) hasta el grado 4 (rigidez en «tubo de plomo»)23. Esta escala ha demostrado su utilidad en la práctica clínica7.
- Numeric rating scale (NRS). Esta escala es una herramienta válida y fiable para evaluar la espasticidad de los pacientes con EM. Valora de 0 a 10 la intensidad de la espasticidad experimentada por el paciente7.
- Escala de espasmos de Penn. Mide el número de espasmos que el paciente experimenta en un período de tiempo determinado7.
Tabla 5. Escala de Ashworth modificada para clasificar la espasticidad
| Grado | Descripción |
| 0 | Sin aumento del tono muscular. |
| 1 | Ligero aumento del tono muscular, manifestado por un «enganche» y relajación o por una resistencia mínima al final del arco del movimiento cuando se mueve la parte afectada en flexión o extensión. |
| 1+ | Ligero aumento del tono muscular, manifestado por un «enganche» seguido de una resistencia mínima en menos de la mitad del resto del arco de movimiento. |
| 2 | Incremento más acusado de la resistencia del músculo durante la mayor parte del arco de movimiento, pero la parte afectada se mueve fácilmente. |
| 3 | Incremento considerable de la resistencia del músculo; el movimiento pasivo en flexión o extensión es difícil. |
| 4 | Las partes afectadas están rígidas en flexión o extensión. |
Fuente: Traducida y adaptada de Bohannon et al.23
Además, hay otras escalas que valoran la repercusión de la espasticidad en la calidad de vida. En este sentido, encontramos dos tipos de escalas7:
- Escalas genéricas. Miden el impacto de la espasticidad en aspectos habituales de la vida de cualquier persona. Se recomienda el cuestionario EuroQol 5D y el SF‑36.
- Escala específica. El cuestionario MusiQol es específico para evaluar la calidad de vida en pacientes con EM que son más sensibles en el corto
Las escalas de calidad de vida son más sensibles en el corto plazo para evaluar el efecto de un tratamiento7.
Tratamiento
¿Cómo se trata?
El tratamiento de la EM puede clasificarse en tratamiento de los brotes, tratamiento modificador de la enfermedad y tratamiento rehabilitador y psicosocial.
Tratamiento de los brotes
Para tratar los brotes o exacerbaciones agudas de EM que cursan con síntomas neurológicos y un aumento de la discapacidad o deficiencias visuales, de la fuerza o la función cerebelosa, se recomienda el tratamiento con metilprednisolona intravenosa a una dosis de 1000 mg diarios durante 3 o 5 días2,24.
El tratamiento con plasmaféresis se reserva para pacientes con déficits neurológicos agudos y graves que no responden a ciclos de corticoterapia intravenosa24.
Tratamiento modificador de la enfermedad
El tratamiento modificador de la enfermedad, aunque no cura la enfermedad, sí tiene muchos beneficios en la EMRR25, ya que previene la aparición de nuevos brotes, hace que estos sean más leves y retrasa la aparición de discapacidad6.
Los FME deben prescribirse solo en centros con una infraestructura adecuada, que permita el seguimiento apropiado de los pacientes, la evaluación integral y la detección de efectos secundarios para abordarlos de forma temprana1. A la hora de instaurar el tratamiento, siempre se deben consultar las características del producto para obtener información sobre la dosificación, las advertencias especiales, las precauciones de uso, las contraindicaciones y la forma de hacer el seguimiento de los efectos secundarios y los posibles daños1.
¿Quién debe empezar el tratamiento con fármacos modificadores de la enfermedad?
Debemos ofrecer tratamiento temprano con FME a los pacientes con CIS que cumplen los criterios de EM y a los pacientes con EMRR activa diagnosticada según los criterios de recaídas clínicas y/o actividad en la RM (lesiones activas, que mejoran con el contraste; lesiones T2 nuevas o con aumento inequívoco de tamaño, evaluadas al menos anualmente)1.
En cuanto a los pacientes con CIS que no cumplen todos los criterios de EM, deberían recibir FME aquellos que presenten una RMN cerebral anormal con lesiones típicas de EM1.
Por su parte, no existe una indicación clara de tratamiento con FME para los pacientes con un síndrome radiológico aislado26.
En cuanto a la EM progresiva, también está indicado el tratamiento modificador de la enfermedad, aunque las opciones terapéuticas son más escasas y la evidencia del beneficio es menor1,27.
¿Qué fármacos modificadores de la enfermedad existen?
Para el tratamiento de los pacientes con EMRR activa, disponemos de una amplia variedad de medicamentos. Podemos dividirlos —según el modo de administración— en medicamentos inyectables (Tabla 6), en infusión (Tabla 7) y orales (Tabla 8).
Tabla 6. Fármacos modificadores de la enfermedad inyectados
| PRINCIPIO ACTIVO | POSOLOGÍA | MECANISMO DE ACCIÓN |
| Acetato de glatiramero | 40 mg 3 veces/sem en días no consecutivos, vía s.c., o
20 mg/d, vía s.c. |
Inmunomodulador con mecanismo de acción mal definido. Se piensa que actúa modificando los procesos inmunitarios responsables de la patogénesis de la EM.
Indicaciones: EMRR. No está indicado en la EMPP ni EMPS. |
| Interferón | Según el tipo. | Inmunomodulador con mecanismo de acción mal definido. Se piensa que actúa modificando los procesos inmunitarios responsables de la patogénesis de la EM. |
| Interferón β-1a | 30 µg/sem, vía i.m., o
22 mcg o 44 mcg 3 veces/sem en días no consecutivos, vía s.c. |
Indicaciones:
· Pacientes diagnosticados de EMRR. · Pacientes con un único acontecimiento desmielinizante, con un proceso inflamatorio activo, si es lo bastante grave como para justificar el tratamiento con corticoesteroides intravenosos, si se han excluido diagnósticos alternativos y si tienen un riesgo elevado para el desarrollo de EM definida clínicamente. Debe interrumpirse en los pacientes que desarrollen EM progresiva. |
| Interferón β-1b | 8 millones de UI (250 µg)/48 h, vía s.c. | Indicaciones:
· Pacientes con EMRR y dos o más recaídas en los dos últimos años. · Pacientes con un único acontecimiento desmielinizante, con un proceso inflamatorio activo, si es lo bastante grave como para justificar el tratamiento con corticoesteroides intravenosos, si se han excluido diagnósticos alternativos y si tienen un riesgo elevado para el desarrollo de EM definida clínicamente. · Pacientes con EMPS que presentan enfermedad activa, demostrada por la aparición de recaídas. |
| Peginterferón I β-1a | Semana 0: 63 µg
Semana 2: 94 µg A partir de la semana 4: 125 µg/14 días Vía s.c. |
Indicaciones:
· Tratamiento de la EMRR en adultos.
|
EMPP: esclerosis múltiple progresiva primaria; EMPS: esclerosis múltiple progresiva secundaria; EMRR: esclerosis múltiple recurrente-remitente.
Fuente: Adaptado de López-González et al.2, Olek et al.25 y las fichas técnicas de los medicamentos (AEMPS).
Tabla 7. Fármacos modificadores de la enfermedad administrados en infusión
| PRINCIPIO ACTIVO | POSOLOGÍA | MECANISMO DE ACCIÓN |
| Natalizumab
|
300 mg/4 sem, en infusión i.v. | Anticuerpo monoclonal recombinante inhibidor selectivo de las integrinas humanas α4. Suprime la actividad inflamatoria e inhibe el reclutamiento de células inmunitarias hacia los tejidos inflamados.
Indicaciones: Monoterapia en adultos con EMRR muy activa en pacientes: · con enfermedad muy activa a pesar de haber recibido un tratamiento completo y adecuado con al menos un FME; · pacientes con EMRR grave de evolución rápida definida por 2 o más brotes discapacitantes en un año, y con 1 o más lesiones realzadas con gadolinio en la RM craneal o un incremento significativo de la carga lesional en T2 en comparación con una RM anterior reciente. |
| Ocrelizumab | Dosis inicial: 300 mg seguidos de 300 mg a las 2 semanas.
Dosis posteriores: 600 mg cada 6 meses. Infusión i.v. |
Anticuerpo monoclonal recombinante que reduce de forma selectiva los linfocitos B que expresan CD20, a través de a través de fagocitosis celular dependiente de anticuerpos (ADCP), citotoxicidad celular dependiente de anticuerpos (ADCC), citotoxicidad dependiente del complemento (CDC) y apoptosis.
Indicaciones: · Pacientes adultos con EMRR con enfermedad activa definida por características clínicas o de imagen. · Pacientes adultos con EMPP temprana, en referencia a la duración de la enfermedad y al nivel de discapacidad, y que presenten actividad inflamatoria en las pruebas de imagen. |
| Alemtuzumab | Tratamiento inicial de 2 ciclos:
· Mes 0: 12 mg/24 h, 5 días consecutivos · Mes 12: 12 mg/24 h, 3 días consecutivos Ciclos adicionales: pueden administrarse, si es necesario, 2 ciclos más de 12 mg, 3 días consecutivos, con un intervalo mínimo de 12 meses respecto al ciclo anterior. Infusión i.v. |
Anticuerpo monoclonal humanizado derivado de ADN recombinante dirigido contra la glicoproteína de superficie celular CD 52, presente en los linfocitos T y B. Actúa a través de la citólisis celular dependiente de anticuerpos y la lisis mediada por el complemento tras unirse a la superficie celular de los linfocitos T y B. Se cree que sus efectos inmunomomoduladores se obtienen a través de la depleción y repoblación de linfocitos.
Indicaciones: EMRR muy activa en: · pacientes con enfermedad muy activa a pesar de haber recibido un ciclo completo y adecuado de tratamiento con al menos FME; · pacientes que rápidamente evolucionen a EMRR grave definida por 2 o más brotes incapacitantes en un año, y con 1 o más lesiones realzadas con gadolinio en la RM cerebral o un aumento significativo de la carga de lesiones en T2 en comparación con una RM reciente. |
EMPP: esclerosis múltiple progresiva primaria; EMPS: esclerosis múltiple progresiva secundaria; EMRR: esclerosis múltiple recurrente-remitente.
Fuente: Adaptado de López-González et al.2, Olek et al.25 y las fichas técnicas de los medicamentos (AEMPS).
El rituximab también se ha utilizado para tratar la EM, aunque no tiene esta indicación en la ficha técnica2,25.
Tabla 8. Fármacos modificadores de la enfermedad administrados por vía oral
| PRINCIPIO ACTIVO | POSOLOGÍA | MECANISMO DE ACCIÓN |
| Dimetilfumarato | 1.ª semana: 120 mg/12 h
A partir de la 2ª semana: 240 mg/12 h Vía oral |
Inmunomodulador con mecanismo de acción no bien definido. Actividad mediada por la activación de la NFR2. El dimetilfumarato regula al alza los genes antioxidantes dependientes de NRF2 en los pacientes.
Indicaciones: adultos con EMRR. |
| Fingolimod | 0,5 mg/24 h, vía oral | Modulador del receptor de la esfingosina-1-fosfato, bloquea la capacidad de los linfocitos de salir de los ganglios linfáticos, lo cual causa la redistribución (no la disminución) de los linfocitos.
Indicaciones: monoterapia en la EMRR muy activa de los siguientes adultos y niños ≥10 años: · Pacientes con enfermedad muy activa a pesar de un curso de tratamiento completo y adecuado con al menos un FME. · Pacientes con EMRR grave de evolución rápida definida por 2 o más brotes discapacitantes en un año, y con 1 o más lesiones realzadas con gadolinio en la RM craneal o un incremento significativo de la carga lesional en T2 en comparación con una RM anterior reciente. |
| Siponimod | Pauta de inicio:
· Días 1 y 2: 0,25 mg/d · Día 3: 0,5 mg/d · Día 4: 0,75 mg/d · Día 5: 1,25 mg/d Pauta de mantenimiento: · A partir del día 6: 2 mg/d Vía oral |
Modulador del receptor de la esfingosina-1-fosfato, con lo cual previene la salida de los linfocitos de los ganglios linfáticos. Esto reduce la recirculación de las células T en el sistema nervioso central (SNC) y limita la inflamación central.
Indicaciones: adultos con EMSP, con enfermedad activa definida por brotes o por características de imagen típicas de actividad inflamatoria. |
| Teriflunomida | 14 mg/24 h, vía oral | Inhibe la enzima mitocondrial DHO-DH, necesaria para la síntesis de novo de la pirimidina, bloqueando la proliferación de linfocitos B y T activados. Su eficacia en la EM puede estar relacionada con la reducción del número global de linfocitos.
Indicaciones: adultos con EMRR. |
| Cladribina | La dosis oral acumulada recomendada es de 3,5 mg/kg de peso a lo largo de 2 años, administrados en un curso de tratamiento de 1,75 mg/kg por año. Cada curso se divide en dos ciclos de tratamiento de 4 o 5 días, uno al inicio del primer mes y otro al inicio del segundo mes del año de tratamiento respectivo. | Análogo nucleósido de la desoxiadenosina, que induce apoptosis celular a través de su forma fosforilada. Produce una depleción selectiva de los linfocitos T y B tanto en proceso de división como en reposo.
Indicaciones: pacientes adultos con EMRR muy activa definida mediante características clínicas o de imagen. |
EMPP: esclerosis múltiple progresiva primaria; EMPS: esclerosis múltiple progresiva secundaria; EMRR: esclerosis múltiple recurrente-remitente.
Fuente: Adaptado de López-González et al.2, Olek et al.25 y las fichas técnicas de los medicamentos (AEMPS).
Otros fármacos son azatioprina, daclizumab y mitoxantrone, entre otros.
En cuanto a la eficacia, los ensayos clínicos muestran que el interferón y el glatiramero tienen la misma utilidad clínica. A su vez, la tasa de recaídas es más favorable con natalizumab que con interferón o glatiramero, aunque no existen ensayos clínicos comparativos directos. El ocrelizumab es más efectivo que el interferón β-1a para reducir las recaídas, y es posible que enlentezca la progresión de la discapacidad. Además de para la EMRR, es el único fármaco modificador de la enfermedad aprobado para la EMPP25.
¿Qué tratamiento modificador de la enfermedad elegir?
En la EMRR no hay un algoritmo consensuado que defina por qué FME empezar. La elección de un medicamento u otro se abordará con el paciente y dependerá de los siguientes factores1:
- Características del paciente y comorbilidades;
- Gravedad/actividad de la enfermedad;
- Perfil de seguridad del fármaco;
- Accesibilidad al medicamento.
En pacientes con CIS y una RM alterada con lesiones sugestivas de EM que no cumplan los criterios de EM, se recomienda ofrecer interferón o acetato de glatiramero1.
En pacientes con EMPS activa, se aconseja considerar el tratamiento con interferón-1a (subcutáneo) o interferón-1b, mitoxantrona, ocrelizumab o cladribina, teniendo en cuenta —tras abordarlo con el paciente— los aspectos de eficacia, el perfil de seguridad y la tolerabilidad de estos fármacos1.
Por otra parte, en pacientes con EMPP debemos considerar el tratamiento con ocrelizumab1.
¿Cómo se evalúa la respuesta al tratamiento?
Para el seguimiento de la respuesta al tratamiento, se aconseja combinar los resultados de la RM con los datos clínicos. Para ello, se recomienda realizar una RM de referencia dentro de los 6 meses posteriores al inicio del tratamiento y compararla con otra realizada a los 12 meses tras comenzar el tratamiento. A la hora de ajustar el tiempo de ambas RM, debe tenerse en cuenta el mecanismo de acción del fármaco y la actividad de la enfermedad1.
En cualquier caso, se aconseja continuar el tratamiento modificador de la enfermedad siempre que el paciente esté estable (según criterios clínicos y de RM) y no muestre problemas de seguridad o tolerancia1.
Tratamiento de los síntomas
En pacientes con EM es frecuente que, además de los FME, se prescriban también medicamentos para tratar los síntomas derivados de la propia enfermedad, como la espasticidad, la fatiga o el temblor, entre otros.
Tratamiento de la espasticidad
El objetivo del tratamiento de los pacientes con EM y espasticidad es reducir el tono muscular en la medida en que mejora la función, sin comprometer la seguridad al abolir todo el tono muscular. En este sentido, el tratamiento solo es necesario cuando la espasticidad representa un problema7,28.
La espasticidad debe abordarse siempre tratando los factores desencadenantes y agravantes (Cuadro 1), si es que se identifican (por ejemplo, dando antibióticos para la infección de orina)28. Además, algunos medicamentos, como el interferón, pueden empeorar transitoriamente la espasticidad7.
Cuadro 1. Factores desencadenantes de la espasticidad
| · Brotes de la esclerosis múltiple
· Progresión de la enfermedad · Cambios en la temperatura corporal (calor, fiebre, ejercicio físico) · Estrés psicológico · Ropa ajustada · Menstruación · Fatiga excesiva · Estímulos dolorosos · Infecciones · Fecalomas · Algunos tratamientos modificadores de la enfermedad · Úlceras por presión · Fracturas · Quemaduras |
Fuente: Oreja-Guevara, et al.7, Balci29
El abordaje terapéutico de la espasticidad normalmente requiere el empleo simultáneo de tratamiento farmacológico y no farmacológico7.
Las intervenciones no farmacológicas para tratar la espasticidad incluyen fisioterapia, programas de ejercicio estructurados, estimulación magnética transcraneal, terapia electromagnética (probablemente efectiva para la fatiga, pero no para la depresión30, estimulación nerviosa eléctrica transcutánea y vibración corporal. Sin embargo, la evidencia disponible de la efectividad de la mayoría de estas intervenciones es limitada y débil desde el punto de vista metodológico31. La fisioterapia y los programas de ejercicio mejoran la actividad y disminuyen la fatiga32.
En cuanto al tratamiento farmacológico, los medicamentos orales siguen siendo la terapia de primera línea para la espasticidad en pacientes con EM. El baclofeno, la tizanidina y el dantroleno han mostrado ser efectivos frente a placebo en estos pacientes, pero se desaconseja el uso general de dantroleno debido a su hepatotoxicidad24.
El baclofeno debe iniciarse a dosis bajas (generalmente de 5 a 10 mg una vez al día a dos o tres veces al día) y aumentarse lentamente hasta la dosis efectiva, ya que aumentos rápidos y dosis superiores a 200 mg al día se asocian a confusión, coma y convulsiones24.
Por su parte, la tizanidina parece igual de eficaz que el diazepam y el baclofeno28. Se comienza en dosis bajas (de 2 a 4 mg al día) y se van aumentando progresivamente hasta un máximo de 36 mg/día7.
Las benzodiacepinas, como el diacepam, se recomiendan cuando no se observa mejoría clínica con baclofeno oral ni con tizanidina24. En los estudios ha mostrado una eficacia similar a baclofeno, pero con mayor sedación. También ha mostrado una eficacia similar a dantroleno, tizanidina y ketazolam28.
La gabapentina suele utilizarse cuando existe dolor neuropático asociado7.
El espray oral de δ-9-tetrahidrocannabinol y cannabidiol (THC/CBD) ha mostrado reducir de manera significativa la espasticidad debida a la EM y refractaria a los tratamientos convencionales (baclofeno, diacepam, tizanidina, gabapentina o combinaciones de ellos)7. Además, mejora los síntomas asociados a la espasticidad —como las alteraciones del sueño, los espasmos, la fatiga y el dolor33—, incluso en los pacientes tratados que no reportan una mejoría de la espasticidad34. Asimismo, mejora la calidad de vida y disminuye las limitaciones para realizar las actividades de la vida diaria33.
El THC/CBD está indicado para mejorar los síntomas en pacientes adultos con espasticidad moderada o grave debida a la EM que no han respondido de forma adecuada a otros medicamentos antiespásticos y que han mostrado una mejoría clínicamente significativa de los síntomas relacionados con la espasticidad durante un período inicial de prueba. Se utiliza añadido a la medicación antiespástica actual del paciente35. En este sentido, añadirlo a la medicación de primera línea aporta una mejoría clínica superior a la mera optimización de dosis de dicha medicación36.
Por otro lado, no hay que olvidar que los cannabinoides pueden causar efectos adversos, por lo que debemos tener precaución con los extractos de cannabis estandarizados versus no estandarizados y el control y regulación de su calidad30.
Otras opciones terapéuticas para tratar la espasticidad en pacientes con EM son las infusiones intratecales de baclofeno y las inyecciones de toxina botulínica24,37.
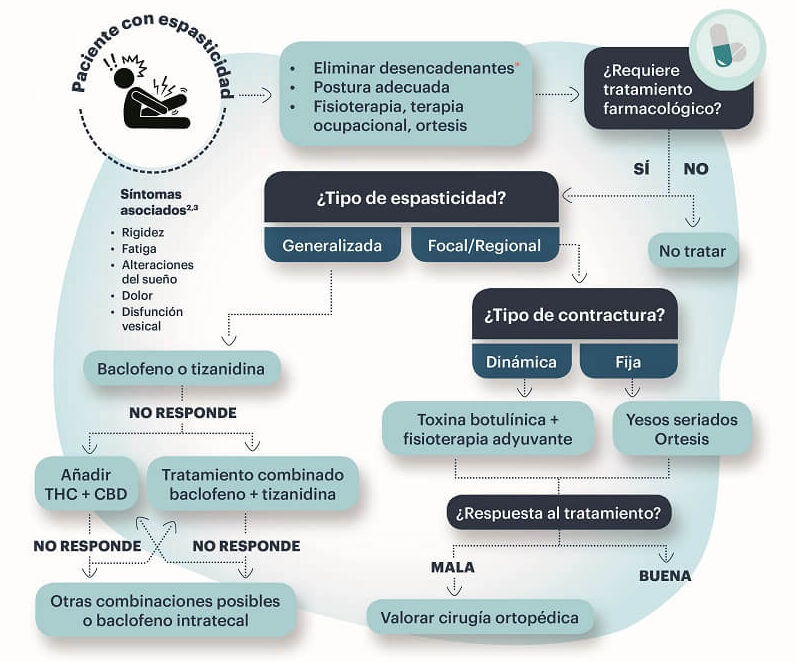
La Figura 2 muestra un algoritmo de tratamiento de la espasticidad asociada a la EM.
Figura 2. Algoritmo de tratamiento de la espasticidad asociada a la esclerosis múltiple
Fuente: Oreja-Guevara, et al.7
Tratamiento de otros síntomas frecuentes
La Tabla 9 recoge los tratamientos farmacológicos más usados para el control de otros síntomas frecuentes asociados a la EM.
Tabla 9. Tratamiento farmacológico de otros síntomas habituales de la EM
| SÍNTOMA | TRATAMIENTO | POSOLOGÍA | OBSERVACIONES |
|
FATIGA |
AMANTADINA |
100-200 mg/día. Vía oral. |
Provoca insomnio, no administrar por la tarde o noche. |
| FLUOXETINA | 20 mg/día. Vía oral. | Aparte del efecto antidepresivo, mejora la fatiga. | |
| PAROXETINA | 20 mg/día. Vía oral. |
Mejora de la fatiga asociada a somnolencia nocturna. |
|
| SERTRALINA | 50 mg/día. Vía oral. | ||
| MODAFINILO | 200 a 400 mg/día. Vía oral. | ||
|
TEMBLOR |
ISONIAZIDA | La dosis varía entre 300-1200 mg/día. Vía oral. | No hay evidencia de su eficacia. Debe administrarse simultáneamente piridoxina como profilaxis de la neuropatía. |
| PROPRANOLOL | 160 a 240 mg/día. Vía oral. | Precisa dosis altas que limitan su administración, debido a los efectos depresores cardiovasculares. | |
| PRIMIDONA | 25-500 mg/día. Vía oral. | Puede reducir el temblor, pero suele provocar sedación. | |
| TRASTORNO DE
LA MARCHA |
FAMPRIDINA |
10 mg/12 h. Vía oral. |
Se valora la respuesta en 14 días. Si no hay mejoría, se debe retirar. Contraindicado en la epilepsia. |
|
DISFUNCIÓN URINARIA |
OXIBUTININA |
15-20 mg/día, (repartidos en 3 o 4 tomas respectivamente, o administrados en 1 única toma nocturna). Tras el control inicial, puede instaurarse una dosis reducida de mantenimiento. Vía oral. | Indicados en la hiperreflexia del detrusor con pequeño volumen residual posmiccional. Si el volumen residual es superior a 100 ml, se recomienda combinar con sondaje intermitente.
Si existe disinergia del esfínter externo del detrusor, puede emplearse medicación antiespástica y bloqueantes α. Como terapia de 2.ª línea, se emplean antidepresivos tricíclicos, como imipramina y nortriptilina, así como toxina botulínica, cannabinoides o capsaicina intravesical. |
| TOLTERODINA | 1-2 mg, 2 veces al día. Vía oral. | ||
| CLORURO DE TROSPIO | 20 mg/12 h. Vía oral. | ||
| MIRABEGRON | 50 mg/24 h. Vía oral. |
Fuente: Lopez-gonzález, et al.2
Tratamiento rehabilitador y psicosocial
En pacientes con esclerosis múltiple que presentan un brote discapacitante grave y en los que los síntomas persisten tras el tratamiento farmacológico, se recomienda valorar la conveniencia de iniciar tratamiento rehabilitador multidisciplinar24. Este tratamiento rehabilitador ha de ser el adecuado al momento evolutivo de la enfermedad, ya que puede mejorar la calidad de vida relacionada con la salud y la funcionalidad en las actividades de la vida diaria24.
Últimas guías publicadas
- Guía elaborada por la European Committee of Treatment and Research in Multiple Sclerosis (ECTRIMS) y la European Academy of Neurology (EAN) sobre el tratamiento farmacológico de personas con esclerosis múltiple:
https://journals.sagepub.com/doi/10.1177/1352458517751049
Montalban X, Gold R, Thompson AJ, Otero-Romero S, Amato MP, Chandraratna D, et al. ECTRIMS/EAN Guideline on the pharmacological treatment of people with multiple sclerosis. Mult Scler. 2018; 24 (2): 96-120.
- Guía elaborada por la American Academy of Neurology (AAN) sobre tratamientos modificadores de la enfermedad en adultos con esclerosis múltiple:
https://www.ncbi.nlm.nih.gov/pubmed/29686117
Rae-Grant A, Day GS, Marrie RA, Rabinstein A, Cree BAC, Gronseth GS, et al. Comprehensive systematic review summary: Disease-modifying therapies for adults with multiple sclerosis. Neurology. 2018; 90 (17): 789-800.
- Guía elaborada por el Consortium of Multiple Sclerosis Centers (CMSC) sobre el protocolo estandarizado de resonancia magnética y guías clínicas para el diagnóstico y seguimiento de la esclerosis múltiple:
https://www.ajnr.org/lookup/doi/10.3174/ajnr.A4539
Traboulsee A, Simon JHH, Stone L, Fisher E, Jones DEE, Malhotra A, et al. Revised recommendations of the consortium of MS centers task force for a standardized MRI protocol and clinical guidelines for the diagnosis and follow-up of multiple sclerosis. Am J Neuroradiol. 2016; 37 (3): 394-401.
Actualizado en 2019: Arevalo O, Riascos R, Rabiei P, Kamali A, Nelson F. Standardizing Magnetic Resonance Imaging Protocols, Requisitions, and Reports in Multiple Sclerosis. J Comput Assist Tomogr. 2019; 43 (1): 1-12. Disponible en: https://journals.lww.com/00004728-201901000-00001
- Guía elaborada por Sociedad Española de Farmacia Hospitalaria sobre atención farmacéutica en esclerosis múltiple:
https://www.sefh.es/bibliotecavirtual/Em19/guia_AF_EM_sefh_mapex.pdf
Sociedad Española de Farmacia Hospitalaria; Lopez-gonzález A; Martínez-López I. Atención farmacéutica en esclerosis múltiple. 2019.
- Guía elaborada por la Generalitat de Catalunya sobre la atención a las personas con esclerosis múltiple:
https://portal.guiasalud.es/wp-content/uploads/2018/12/GPC_518_Esclerosis_mulitple_rapida.pdf
Grupo de trabajo de la Guía de práctica clínica sobre la atención a las personas con esclerosis múltiple. AIAQS y Cemcat, coordinadores. Guía de práctica clínica sobre la atención a las personas con esclerosis múltiple [versión rápida]. Barcelona: Agència d’Informació, Avaluació i Qualitat en Salut. Servei Català de la Salut. Departament de Salut. Generalitat de Catalunya; 2012.
- Guía elaborada por la European collaborative research network that studies MRI in multiple sclerosis (MAGNIMS) sobre los criterios de resonancia magnética para el diagnóstico de esclerosis múltiple:
https://linkinghub.elsevier.com/retrieve/pii/S1474442215003932
Filippi M, Rocca MA, Ciccarelli O, De Stefano N, Evangelou N, Kappos L, et al. MRI criteria for the diagnosis of multiple sclerosis: MAGNIMS consensus guidelines. Lancet Neurol. 2016; 15 (3): 292-303.
Recursos relacionados
- Consulta rápida: Síntomas asociados a la espasticidad
- Consulta rápida: Factores desencadenantes de la espasticidad
- Consulta rápida: Algoritmo de tratamiento de la espasticidad
- Revisión bibliográfica: Espasticidad en la esclerosis múltiple
Recursos en línea y apps para médicos
Existen multitud de webs y aplicaciones para dispositivos móviles diseñadas para facilitar el abordaje de las enfermedades cardiovasculares (entre ellas, las dislipemias) por parte de los profesionales.
Recursos relacionados
- Sección: Webs y apps para médicos
- Blog: Redes sociales para médicos y pacientes
- Blog: Cómo organizar las webs y los contenidos de internet
Webs de neurología y esclerosis múltiples para médicos
Sociedad Española de Neurología (SEN)
Su objetivo principal es promocionar y fomentar el progreso de la neurología. Los miembros pueden ser tanto neurólogos como médicos de otras especialidades con interés en neurología.
Los socios tienen acceso a formación continuada acreditada, publicaciones, guías y protocolos, y suscripción gratuita a la revista oficial de la SEN (Neurología), y a Neurosciences and History.
Esta web publica la Revista de Neurología, que fomenta y difunde el conocimiento generado en lengua española sobre neurociencia, tanto clínica como experimental. Forma parte del Journal Citation Report, con un factor de impacto en 2018 de 0,485. La revista es de acceso libre, aunque para descargarla debes registrarte.
Además, la web contiene una serie de herramientas para aumentar y actualizar los conocimientos en neurología. Por ejemplo, ofrece másteres online, en colaboración con distintas universidades, así como noticias de neurología y contenidos específicos de esclerosis múltiple y otras patologías neurológicas.
Los contenidos se pueden consultar de forma libre.
Asociación Madrileña de Neurología
En su página web encontrarás guías clínicas, índices y escalas, criterios diagnósticos y cursos, entre otros recursos de neurología.
European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS)
Es la mayor organización profesional del mundo dedicada a la comprensión y el tratamiento de la esclerosis múltiple. Su misión es facilitar la comunicación, crear sinergias y promover la invesigación y el aprendizaje entre los profesionales, con el fin último de beneficiar a las personas afectadas de EM.
En su web puedes encontrar información sobre sus congresos, cursos y publicaciones. Entre estas, tienes guías de acceso libre y el Multiple Sclerosis Journal, con algunos artículos accesibles a todo el público.
Centre d´Esclerosis Múltiple de Catalunya (Cemcat)
Cemcat es un centro de referencia en esclerosis múltiple. Su objetivo es prestar asistencia sanitaria a las personas con enfermedades neuroinmunológicas, especialmente esclerosis múltiple. Forma parte de Red Española de Esclerosis Múltiple y la organización ECTRIMS (European Committee for Treatment and Research in Multiple Sclerosis), entre otras muchas sociedades científicas.
Aparte de sus servicios asistenciales, el centro tiene una larga trayectoria en investigación y docencia. En su sección dirigida a profesionales, se pueden consultar los ensayos clínicos en los que participa el Cemcat, junto con el listado de artículos publicados por el centro. Tienen cursos y másteres sobre esclerosis múltiple dirigidos a diferentes perfiles de profesionales sanitarios.
Apps de neurología y esclerosis múltiple para médicos
Multiple Sclerosis @POC
Aplicación de apoyo a las decisiones clínicas de los profesionales, ya que ofrece acceso fácil y rápido a contenido médico seleccionado y basado en la evidencia. Los clínicos pueden navegar preguntando por voz, en lenguaje natural, lo cual acelera la búsqueda de respuestas para mejorar la atención en la cabecera del paciente. EL sistema se basa en inteligencia artificial.
Disponible en inglés para dispositivos Apple.
Información para pacientes
Descargar en PDF los Consejos para pacientes con esclerosis múltiple
Introducción
El manejo no farmacológico de la esclerosis múltiple resulta de vital importancia para contribuir a mejorar la calidad de vida de estos pacientes. A continuación, se muestran unos consejos para ayudar a los pacientes de esclerosis múltiple en su vida diaria.
¿Cómo tengo que adaptar mi vivienda?
La comodidad en el hogar es un factor importante para los pacientes con esclerosis múltiple. Algunas recomendaciones prácticas son:
- En la vivienda en general: adaptar el espacio si se necesita silla de ruedas. Evitar los desniveles (se pueden poner rampas) y retirar las alfombras para prevenir caídas. Además, elevar la altura de los asientos ayuda a levantarse más fácilmente.
- En el dormitorio: tener un acceso fácil a la cama y suficiente espacio para poder vestirse con comodidad.
- En el baño: elevar el inodoro, adaptar la ducha o la bañera con asientos en su interior e instalar grifos de palanca facilitarán mucho la vida diaria. Los cepillos eléctricos con mango ancho son más fáciles de usar.
- En la cocina: situar los armarios y electrodomésticos a una altura cómoda y accesible. La vitrocerámica también es más fácil de usar y previene quemaduras.
¿Qué puedo hacer para facilitar mi día a día?
Consejos para vestirse
- Empezar a ponerse la ropa por la zona con la que se tenga mayor dificultad.
- Las prendas amplias —por ejemplo, de estilo deportivo— facilitan mucho el vestirse diariamente. Las cremalleras y el velcro requieren menos esfuerzo que los botones.
- Es más fácil calzarse de forma autónoma si se usa calzado elástico (sin cordones).
- Existen dispositivos especiales para ayudar a ponerse algunas prendas de ropa (por ejemplo, los pantalones o los calcetines).
Alimentación
La esclerosis múltiple puede causar dificultades para tragar. En este caso, es importante adaptar la alimentación para que sea más fácil de masticar y para evitar los atragantamientos. En este sentido, es útil evitar los alimentos peligrosos (frutos secos, aceitunas), comer alimentos blandos y triturar los más duros. En cuanto a los líquidos, se pueden usar espesantes. Evitar el uso de pajitas.
En casos más graves, una opción es poner una sonda. Se debe comer sentado en una postura lo más erguida posible y no hablar mientras se come, para no atragantarse. Hay cubiertos especiales que facilitan el agarre y permiten comer sin ayuda.
Respecto a la dieta, no hay ninguna recomendada para el tratamiento de la esclerosis múltiple, más allá de una variada y equilibrada (igual que en cualquier persona sin la enfermedad). Se desaconseja el alcohol y tabaco.
Si se pierde peso, se puede aumentar las calorías de la dieta añadiendo sofritos, nata, mantequilla, aceite o frutos secos machacados, y empanando o rebozando los alimentos. Puede ser beneficioso también tomar suplementos nutricionales.
¿De qué modo puedo superar las dificultades?
Existen muchas recomendaciones para mejorar la calidad de vida de los pacientes con EM en su día a día.
Fatiga
- Programar las actividades diarias para hacer lo más importante en el momento en el que se está más descansado (que suele ser por la mañana).
- Hacer descansos frecuentes durante las actividades.
- Evitar el calor: disminuir la temperatura ambiental, beber agua fría, tomar una ducha fresca… El calor empeora la fatiga.
- Hacer gimnasia: el ejercicio físico mejora la fatiga a largo plazo. Un fisioterapeuta puede ayudar a crear un plan de ejercicios adaptado a la condición individual de cada persona.
Espasticidad
- La fisioterapia puede mejorar la rigidez, los espasmos y las contracturas (es decir, la espasticidad). Los ejercicios deben hacerse con regularidad, también en casa.
- El frío puede ser beneficioso.
- Es preciso mantener una postura correcta y hacer cambios posturales frecuentes para evitar las contracturas.
Equilibrio y coordinación de movimientos
- Concentrarse en los movimientos que se va a hacer y mantener la vista en un punto durante el movimiento ayuda a manejar muchas situaciones, hasta en trastornos graves.
- Los temblores disminuyen añadiendo un peso mediante brazaletes, tobilleras, etc. Usarlos demasiado tiempo puede causar fatiga.
- Usar bastones da mucha seguridad y permite mantener la autonomía más tiempo.
- Las plantillas especiales y otros dispositivos ortopédicos también pueden ser de gran ayuda.
Trastornos urinarios
- La incontinencia puede prevenirse educando la vejiga, orinando cada 2-3 horas y tratando de aumentar el intervalo. Es mejor no beber mucha agua a la vez ni, al menos, desde 2 horas antes de dormir.
- Las infecciones de orina son frecuentes y se debe aprender a reconocerlas.
- En caso de dificultad para orinar, hay ejercicios que pueden inducir la micción.
Estreñimiento
- No es necesario hacer deposición diariamente, pero sí 3 veces por semana. • Una dieta rica en fibra y líquidos es fundamental.
- La mejor posición para defecar es apoyando los pies en una banqueta, de forma que las rodillas queden más altas que las caderas.
- Se debe establecer una rutina diaria; por ejemplo, intentar hacer deposición después de una comida principal, ya que es el momento en el cual los intestinos se mueven más.
Estado de ánimo
- El ejercicio físico (por ejemplo, el yoga y el taichí) mejora el estado de ánimo.
- Las actividades culturales (cine, teatro) y de ocio, así como las actividades en grupo, también contribuyen a mantener un buen estado de ánimo y evitar el aislamiento.
- Las técnicas de relajación y meditación pueden ser útiles para controlar la ansiedad.
- Puede ser necesario consultar con un psicólogo u otro profesional para hacer frente a la depresión o la ansiedad.
Recursos en PDF para los pacientes
Almirallmed
FEM y Cemcat
Recursos en línea y apps para pacientes
El consejo del médico puede completarse recomendando webs y apps que sirvan a los pacientes para conocer mejor la esclerosis múltiple y para ayudarlos a mejorar su calidd de vida.
Recursos relacionados
- Sección: Webs y apps para pacientes
- Blog: ¿Cómo usar las redes sociales para comunicarte con los pacientes?
Webs de esclerosis múltiple para pacientes
En esta web se explica de manera muy visual qué es la esclerosis múltiple, cómo se llega al diagnóstico y cuáles son los síntomas. Además, se facilitan recursos para pacientes y familiares, como consejos dietéticos, juegos para comprender mejor la enfermedad y vídeos con testimonios de pacientes.
También tienen ejercicios específicos para mejorar la movilidad y disminuir la espasticidad, con vídeos explicativos y una guía descargable en formato PDF.
Observatorio Esclerosis Múltiple
Este portal de la Fundación Esclerosis Múltiple contiene muchos recursos para los pacientes con esclerosis múltiple, como información general sobre la enfermedad, explicación de los síntomas y recomendaciones para mejorarlos, o consejos útiles para el día a día.
Esta página está diseñada para que el paciente en tratamiento con Sativex® (Delta-9-tetrahidrocannabinol/cannabidiol) encuentre toda aquella información que se le ha explicado en el momento de empezar el tratamiento. De esta forma, se puede reforzar al trabajo informativo realizado en la consulta.
El paciente dispone de todo lo que precisa saber sobre Sativex®, incluida la aplicación correcta, la determinación de la dosis y el abordaje de los posibles efectos adversos.
Además, contiene materiales descargables para el paciente, como, por ejemplo, ejercicios para mejorar la espasticidad.
Para acceder la página, se necesita un código que se facilita al paciente con la medicación.
Bibliografía
- Montalban X, Gold R, Thompson AJ, Otero-Romero S, Amato MP, Chandraratna D, et al. ECTRIMS/EAN Guideline on the pharmacological treatment of people with multiple sclerosis. Mult Scler J [Internet]. 2018 [consultado 5 mayo 2020]; 24 (2): 96-120. Disponible en: https://journals.sagepub.com/doi/10.1177/1352458517751049
- Lopez-gonzález A; Martínez-López I. Atención farmacéutica en esclerosis múltiple. Sociedad Española de Farmacia Hospitalaria [Internet]. 2019 [consultado 27 mayo 2020]. Disponible en: https://www.sefh.es/bibliotecavirtual/Em19/guia_AF_EM_sefh_mapex.pdf
- Olek MJ, Mowry E. Pathogenesis and epidemiology of multiple sclerosis. UpToDate [Internet]. 2020 [consultado 27 mayo 2020].
- Flachenecker P, Henze T, Zettl UK. Spasticity in patients with multiple sclerosis – clinical characteristics, treatment and quality of life. Acta Neurol Scand. 2014;129(3):154-62.
- Olek MJ, Narayan RN, Frohman EM, Frohman TC. Manifestations of multiple sclerosis in adults. UpToDate [Internet]. 2020 [consultado 27 mayo 2020].
- Consulta de Neuroinmunología. Guía para el manejo del paciente con Esclerosis Múltiple. Hospital La Mancha, Centro de Alcázar de San Juan y Hospital General de Tomelloso [Internet]. 2019 [consultado 27 mayo 2020]. Disponible en: https://www.serviciofarmaciamanchacentro.es/images/stories/recursos/recursos/protocolo/neurologia/gua%20esclerosis%20mltiple%20farmacia_neuro_completa.pdf
- Oreja-Guevara C, González-Segura D, Vila C. Spasticity in multiple sclerosis: results of a patient survey. Int J Neurosci. 2013; 123 (6): 400-8.
- Thompson AJ, Banwell BL, Barkhof F, Carroll WM, Coetzee T, Comi G, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol [Internet]. 2018 [consultado 27 mayo 2020]; 7 (2): 162-173. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29275977/
- Olek MJ, Howard J. Clinical presentation, course, and prognosis of multiple sclerosis in adults. UpToDate [Internet]. 2020 [consultado 28 mayo 2020].
- Rice CM, Cottrell D, Wilkins A, Scolding NJ. Primary progressive multiple sclerosis: Progress and challenges. J Neurol Neurosurg Psychiatry [Internet]. 2013 [consultado 11 mayo 2020]; 84 (10): 1100-6. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/23418213
- Olek MJ, Howard J. Evaluation and diagnosis of multiple sclerosis in adults. UpToDate [Internet]. 2020 [consultado 28 mayo 2020].
- Yamout B, Sahraian M, Bohlega S, Al-Jumah M, Goueider R, Dahdaleh M, et al. Consensus recommendations for the diagnosis and treatment of multiple sclerosis: 2019 revisions to the MENACTRIMS guidelines. Mult Scler Relat Disord [Internet]. 2020 [consultado 25 mayo 2020]; 37: 101459. Disponible en: https://doi.org/10.1016/j.msard.2019.101459
- Files DK, Jausurawong T, Katrajian R, Danoff R. Multiple Sclerosis. Prim Care Clin Off Pract [Internet]. 2015 [consultado 25 mayo 2020]; 42 (2): 159-75. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S0095454315000184
- Dobson R, Giovannoni G. Multiple sclerosis – a review. Eur J Neurol [Internet]. 2019 [consultado 6 mayo 2020]; 26 (1): 27-40 Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/30300457
- Arevalo O, Riascos R, Rabiei P, Kamali A, Nelson F. Standardizing Magnetic Resonance Imaging Protocols, Requisitions, and Reports in Multiple Sclerosis. J Comput Assist Tomogr [Internet]. 2019 [consultado 1 mayo 2020] ;43 (1): 1-12. Disponible en: https://journals.lww.com/00004728-201901000-00001
- Traboulsee A, Simon JHH, Stone L, Fisher E, Jones DEE, Malhotra A, et al. Revised recommendations of the consortium of MS centers task force for a standardized MRI protocol and clinical guidelines for the diagnosis and follow-up of multiple sclerosis. Am J Neuroradiol [Internet]. 2016 [consultado 1 mayo 2020]; 37 (3): 394-401. Disponible en: https://www.ajnr.org/lookup/doi/10.3174/ajnr.A4539
- Filippi M, Rocca MA, Ciccarelli O, De Stefano N, Evangelou N, Kappos L, et al. MRI criteria for the diagnosis of multiple sclerosis: MAGNIMS consensus guidelines. Lancet Neurol [Internet]. 2016 [consultado 5 mayo 2020]; 15 (3): 292-303. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S1474442215003932
- Forslin Y, Granberg T, Jumah AA, Shams S, Aspelin P, Kristoffersen-Wiberg M, et al. Incidence of radiologically isolated syndrome: A population-based study. Am J Neuroradiol. 2016; 37 (6): 1017-22.
- Dobson R, Ramagopalan S, Davis A, Giovannoni G. Cerebrospinal fluid oligoclonal bands in multiple sclerosis and clinically isolated syndromes: A meta-analysis of prevalence, prognosis and effect of latitude. J Neurol Neurosurg Psychiatry [Internet]. 2013 [consultado 12 mayo 2020]; 84 (8): 909-14. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/23431079
- Oh J, Vidal-Jordana A, Montalban X. Multiple sclerosis: Clinical aspects. Curr Opin Neurol [Internet]. 2018 [consultado 12 mayo 2020]; 31 (6): 752-759. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30300239/
- Petzold A, de Boer JF, Schippling S, Vermersch P, Kardon R, Green A, et al. Optical coherence tomography in multiple sclerosis: A systematic review and meta-analysis. Lancet Neurol [Internet]. 2010 [consultado 27 mayo 2020]; 9: 921-32.
- Hutchinson M. Optical coherence tomography should be part of the routine monitoring of patients with multiple sclerosis: Commentary. Mult Scler [Internet]. 2014 [consultado 12 mayo 2020]; 20 (10): 1302-3. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/25160124
- Bohannon RW, Smith MB. Interrater Reliability of a Modified Ashworth Scale of Muscle Spasticity. Phys Ther [Internet]. 1987 [consultado 1 junio 2020]; 67 (2): 206-7. Disponible en: https://academic.oup.com/ptj/article/2728158/Interrater
- Grupo de trabajo de la Guía de práctica clínica sobre la atención a las personas con esclerosis múltiple. AIAQS y Cemcat, coordinadores. Guía de práctica clínica sobre la atención a las personas con esclerosis múltiple [versión rápida]. Barcelona: Agència. 2012 [consultado 13 mayo 2020]; Disponible en: https://portal.guiasalud.es/wp-content/uploads/2018/12/GPC_518_Esclerosis_mulitple_rapida.pdf
- Olek MJ, Mowry. Disease-modifying treatment of relapsing-remitting multiple sclerosis in adults. UpToDate [Internet]. 2020 [consultado 28 mayo 2020].
- Olek MJ, Mowry. Management of clinically and radiologically isolated syndromes suggestive of multiple sclerosis. UpToDate [Internet]. 2020 [consultado 28 mayo 2020].
- Olek MJ, Mowry. Treatment of progressive multiple sclerosis in adults. UpToDate [Internet]. 2020 [consultado 1 junio 2020].
- Otero-Romero S, Sastre-Garriga J, Comi G, Hartung HP, Soelberg-Sørensen P, Thompson AJ, et al. Pharmacological management of spasticity in multiple sclerosis: Systematic review and consensus paper. Multiple Sclerosis Journal. 2016; 22 (11): 1386-1396.
- Balci BP. Spasticity Measurement. Arch Neuropsychiatry [Internet]. 2018 [consultado 1 junio 2020]; 55 (Suppl 1): S49-S53. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6278623/
- Yadav V, Bever C, Bowen J, Bowling A, Weinstock-Guttman B, Cameron M, et al. Summary of evidence-based guideline: Complementary and alternative medicine in multiple sclerosis: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology [Internet]. 2014 [consultado 13 mayo 2020]; 82 (12): 1083-92. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24663230/
- Amatya B, Khan F, La Mantia L, Demetrios M, Wade DT. Non pharmacological interventions for spasticity in multiple sclerosis. Cochrane Database of Systematic Reviews [Internet]. 2013 [consultado 13 mayo 2020]; 2: CD009974. Disponible en: https://pubmed.ncbi.nlm.nih.gov/23450612/
- Carlos Gil Am, Castro Campos JL. Eficacia, efectividad y seguridad de la fisioterapia en pacientes con esclerosis múltiple. Agencia de Evaluación de Tecnologías Sanitarias de Andalucía. Junta de Andalucía [Internet]. 2017 [consultado 2 junio 2020]. Disponible en: https://www.aetsa.org/download/publicaciones/AETSA_ListaREF_FISIOTERAPIA-ESCLEROSIS-MULTIPLE-DEFINITIVO.pdf
- Akgün K, Essner U, Seydel C, Ziemssen T. Daily Practice Managing Resistant Multiple Sclerosis Spasticity With Delta-9-Tetrahydrocannabinol: Cannabidiol Oromucosal Spray: A Systematic Review of Observational Studies. J Cent Nerv Syst Dis. 2019;11:1179573519831997. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6413425/
- Patti F, Chisari C, Solaro C, Benedetti MD, Berra E, Bianco A, et al. Effects of THC/CBD oromucosal spray on spasticity-related symptoms in people with multiple sclerosis: results from a retrospective multicenter study. Neurol Sci. 2020.
- Sativex®. Ficha técnica. Agosto 2018. Agencia Española de Medicamentos y Productos Sanitarios. Centro de Información del Medicamento. Disponible en: https://cima.aemps.es/cima/dochtml/ft/72544/FT_72544.html
- Markovà J, Essner U, Akmaz B, Marinelli M, Trompke C, Lentschat A, Vila C. Sativex® as Add-on therapy Vs. further optimized first-line ANTispastics (SAVANT) in resistant multiple sclerosis spasticity: a double-blind, placebo-controlled randomised clinical trial. Int J Neurosci. 2019; 129 (2): 119-128.
- Simpson DM, Hallett M, Ashman EJ, Comella CL, Green MW, Gronseth GS, et al. Practice guideline update summary: Botulinum neurotoxin for the treatment of blepharospasm, cervical dystonia, adult spasticity, and headache Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology [Internet]. 2016 [consultado 13 mayo 2020]; 86 (19): 1818-26. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27164716/