Diagnóstico diferencial de la dermatitis atópica

En esta infografía llena de imágenes, te contamos las principales características de la dermatitis atópica y cómo diferenciarla de otras enfermedades dermatológicas
Dermatitis atópica y calidad de vida

Prurito, alteraciones del sueño, mayor riesgo de depresión… Descubre cómo afecta la dermatitis atópica a la calidad de vida.
Almirall: Lebrikizumab demuestra una mejora significativa de la piel y un alivio del picor cuando se combina con corticosteroides tópicos en personas con dermatitis atópica en el tercer estudio de fase III
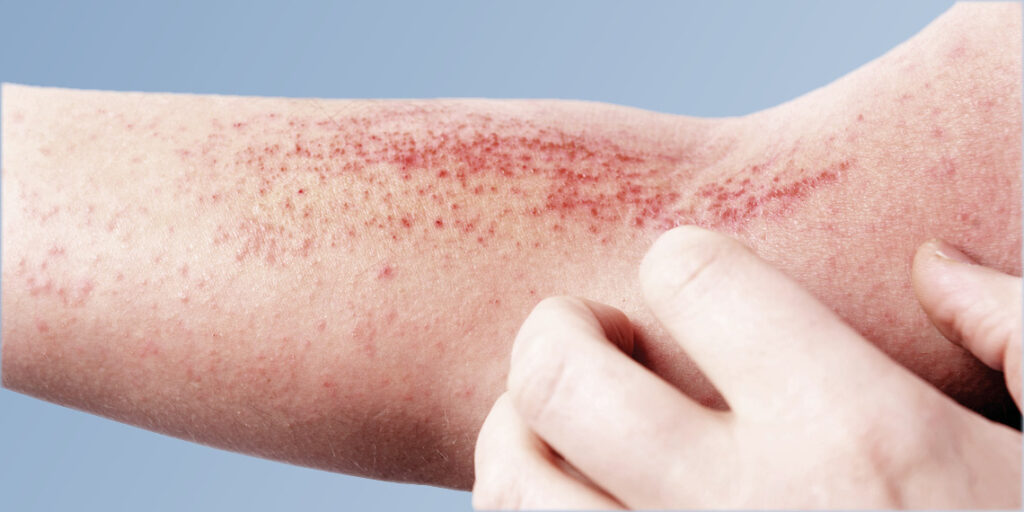
El estudio ha cumplido todos los criterios de valoración primarios y los secundarios principales Lebrikizumab ha mostrado un perfil de seguridad consistente con los estudios previos ya realizados en dermatitis atópica El año que viene se presentarán solicitudes reglamentarias a nivel mundial basadas en los datos del programa de ensayos clínicos de fase III BARCELONA (ESPAÑA), 21 de diciembre de 2021. Lebrikizumab, un inhibidor de la citocina IL-13, mejoró significativamente la gravedad de la enfermedad cuando se combinó con corticosteroides tópicos (TCS) en personas con dermatitis atópica (DA) de moderada a grave en un tercer ensayo pivotal de fase III (ADhere) anunciado hoy por Almirall S.A. (BME: ALM). En la semana 16, el estudio alcanzó todos los criterios de valoración primarios y los secundarios clave.
Casos clínicos de residentes de dermatología 2020

Casos clínicos sobre diversas patologías dermatológicas.
Lebrikizumab mejoró significativamente el aclaramiento de la piel y el picor en personas con dermatitis atópica de moderada a grave en dos ensayos de fase 3
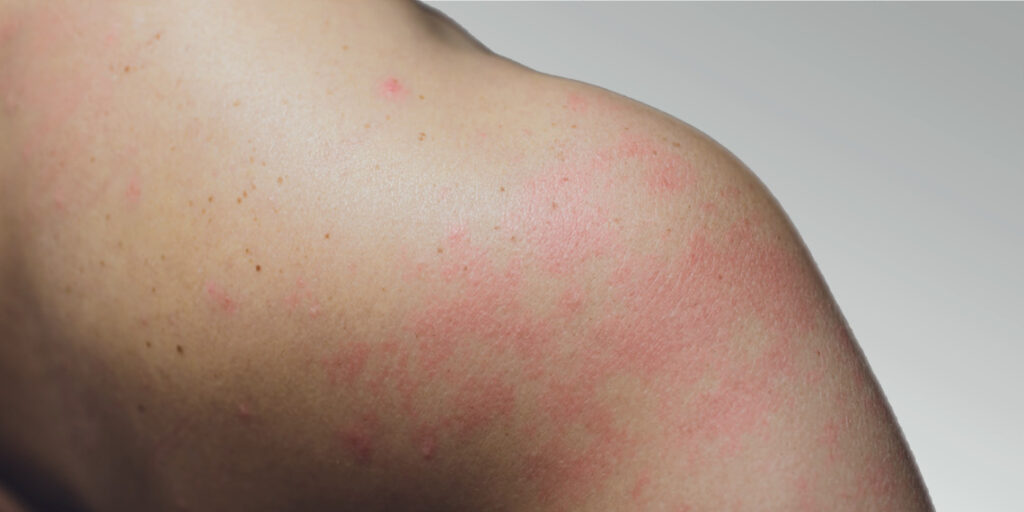
Los criterios de valoración primarios y todos los secundarios principales, incluido el picor, la interferencia del picor en el sueño y la calidad de vida del paciente, se cumplieron en la semana 16 en dos ensayos pivotales de fase 3 El perfil de seguridad es coherente con los estudios anteriores de lebrikizumab en dermatitis atópica BARCELONA, España. 16 de agosto de 2021. Lebrikizumab produjo una mejora significativa de al menos un 75% en el aclaramiento de la piel en más de la mitad de las personas con dermatitis atópica (DA) de moderada a grave, medida mediante el Índice de Gravedad y Localización del Eccema (Eczema Area and Severity Index, EASI), en los estudios de fase 3 ADvocate 1 y ADvocate 2, cuyos datos han sido anunciados hoy por Almirall SA (BME: ALM). En los resultados preliminares de estos dos estudios en monoterapia en pacientes con DA, se cumplieron los criterios de valoración primarios y todos los secundarios principales, incluido el aclaramiento de la piel y la mejora del picor, en la semana 16 de tratamiento. Lebrikizumab es un nuevo anticuerpo monoclonal (mAb) que se une a la IL-13 soluble con una afinidad alta, tiene una elevada biodisponibilidad, una larga vida media, y además bloquea la señalización de la IL-13.1-4 La Agencia de Alimentos y Medicamentos de Estados Unidos (FDA) ha concedido la designación de vía rápida a lebrikizumab para la DA de moderada a grave en pacientes adultos y adolescentes (entre 12 y 18 años de edad con un peso mínimo de 40 kg). La designación de vía rápida se otorga a un medicamento que está destinado a tratar una afección grave y los datos demuestran su potencial para abordar una necesidad médica no cubierta.