Patología
¿Qué es la insuficiencia cardíaca?
La insuficiencia cardíaca (IC) es un síndrome clínico complejo caracterizado por la presencia de síntomas (como disnea, fatiga y limitación del esfuerzo) y signos característicos (como crepitantes pulmonares, edema periférico o el aumento de la presión venosa yugular) debidos a disfunción cardíaca. Esta disfunción cardíaca puede ser consecuencia de un deterioro estructural o funcional en el llenado ventricular o en la eyección de sangre, o bien de una combinación de ambos1–4. Hemodinámicamente, la IC es un trastorno en el que el corazón es incapaz de bombear sangre a los tejidos corporales a un ritmo acorde con sus necesidades, o bien puede hacerlo solo a expensas de altas presiones de llenado5.
La IC tiene un curso clínico variable y complejo y está caracterizado por períodos de estabilidad clínica y de descompensación en los que los pacientes pueden o no presentar signos físicos asociados, como los relacionados con la retención de líquidos5.
La insuficiencia cardíaca (IC) es un síndrome clínico complejo caracterizado por síntomas característicos, como disnea y fatiga, y signos de disfunción cardíaca como causa de estos síntomas1–4.
¿Cómo se clasifica la insuficiencia cardíaca?
Tradicionalmente, la IC se ha subclasificado en términos generales según la fracción de eyección del ventrículo izquierdo (FEVI) en 3 fenotipos diferentes3,6:
- IC con fracción de eyección conservada (IC-FEc, en la que la FEVI es ≥50 %), con síntomas y signos de IC y con signos de alteraciones cardíacas estructurales y/o funcionales y/o aumento de péptidos natriuréticos;
- IC con fracción de eyección media, límite o ligeramente reducida (IC-FElr, en la que la FEVI es 41 %-49 %);
- IC con fracción de eyección reducida (IC-FEr, en la que la FEVI es ≤40 %).
La guía AHA/ACC/HFSA de 2022 añade otra categoría: insuficiencia cardíaca con fracción de eyección mejorada (IC-FEm), definida por una FEVI previa ≤40 % y luego, durante el seguimiento, >40 %7.
Cada una de estas categorías de IC tiene mecanismos fisiopatológicos, respuestas a los medicamentos y características epidemiológicas particulares.
¿Es frecuente la insuficiencia cardíaca?
A pesar de los avances y mejoras en las estrategias de tratamiento, la IC sigue siendo una carga socioeconómica significativa y conduce a problemas de salud individuales debido a sus altas tasas de mortalidad y reingreso. A nivel mundial, se estima que más de 64 millones de personas padecen IC8. Actualmente, su incidencia en Europa es de aproximadamente 5 por cada 1000 adultos-año9.
Según estudios epidemiológicos, la prevalencia estimada de IC es aproximadamente del 1 % al 2 % de la población adulta general10,11, aunque es probable que la prevalencia real sea mayor debido a que los estudios generalmente solo incluyen casos de IC reconocidos o ya diagnosticados12.
Esta prevalencia aumenta con la edad, siendo del 1 % en personas menores de 55 años y superior al 10 % en individuos de 70 años o más13,14. La prevalencia de la IC continúa aumentando, debido en gran medida al envejecimiento de la población, la epidemia de hipertensión, obesidad y coronariopatías y una mejor supervivencia de los pacientes con IC15.
Una vez desarrollada, la IC produce una morbilidad y mortalidad significativas, con tasas anuales de mortalidad y hospitalización del 7,2 y del 31,9 %, respectivamente, entre pacientes con IC crónica. Estas tasas pueden aumentar al 17,4 % y al 43,9 % entre los pacientes hospitalizados por IC aguda16.
En cuanto a la prevalencia según fenotipo, la prevalencia de IC-FEr varía debido a las diferentes definiciones en cuanto a afectación del ventrículo izquierdo (VI), a los valores de corte de la FEVI, al rango de entornos clínicos y a diversos factores demográficos. No obstante, se estima que alrededor del 50 % de las personas con IC tiene IC-FEr, aunque estos datos proceden principalmente de estudios en pacientes hospitalizados17.
La IC-FEr se asocia a una alta carga de mortalidad y tasa de reingreso, lo cual la convierte en uno de los desafíos de salud pública más importantes18.
La IC-FEc afecta a más mujeres que hombres19, pero las tasas de incidencia son similares en todas las razas y etnias20. Aunque los pacientes con IC-FEc tienen menor riesgo de muerte que los pacientes con IC-FEr, la mortalidad absoluta sigue siendo alta21.
¿Cuál es la fisiopatología y los factores de riesgo de la insuficiencia cardíaca?
Aunque la etiología y fisiopatología de la IC aún están por determinar, se ha propuesto que la causa subyacente de la enfermedad sea una inflamación sistémica crónica de bajo grado mediada por el factor de necrosis tumoral (TNF) α y el factor de crecimiento transformante (TGF) β122,23. Esta inflamación sistémica, mediada por microARN, está inducida por una disfunción microvascular que está presente incluso desde antes de que aparezcan los síntomas clínicos22,24.
La presencia de ciertas comorbilidades parece desempeñar un papel fundamental en el desarrollo de la inflamación sistémica y la fisiopatología de la IC. La hipertensión arterial es uno de los principales factores que conducen a mayor rigidez de los vasos sanguíneos y a una mayor poscarga del ventrículo izquierdo25 y es el factor de riesgo cardiovascular observado con más frecuencia entre pacientes con IC-FEc26. Se cree que la remodelación miocárdica inducida por la hipertensión y el aumento de las presiones de llenado del ventrículo izquierdo son los principales mecanismos del desarrollo de este tipo de IC27.
Otras comorbilidades frecuentes implicadas en el desarrollo del proceso inflamatorio son la obesidad, diabetes, fibrilación auricular, síndrome metabólico, enfermedad pulmonar obstructiva crónica, trastornos respiratorios del sueño, disfunción renal y anemia28. Junto con otros factores de riesgo atribuibles al desarrollo de IC, como la prediabetes y la arteriosclerosis, el envejecimiento también parece tener un gran impacto29.
Diferencias entre la insuficiencia cardíaca con fracción de eyección conservada y la insuficiencia cardíaca con fracción de eyección reducida
Se han observado diferencias en los factores etiológicos que afectan a los pacientes con IC-FEc y los que afectan a los que padecen IC-FEr30.
La coronariopatía y el infarto de miocardio se han establecido como los principales factores de riesgo para el desarrollo de IC-FEr31. Además, estudios epidemiológicos muestran que mientras la edad avanzada y el sexo femenino son factores de riesgo independientes para el desarrollo de IC-FEc, el sexo masculino se asocia con un mayor riesgo de IC-FEr (aunque no como un factor de riesgo independiente)32. Así, aunque en comparación con los pacientes con IC-FEc los pacientes con IC-FEr tienen menos probabilidades de presentar valvulopatías, hipertensión y fibrilación auricular, también tienen más probabilidades de sufrir un infarto de miocardio o un bloqueo de rama izquierda28.
Además, en comparación con los pacientes con IC-FEc, los pacientes con IC-FEr tienen una presión arterial significativamente más baja, una frecuencia cardíaca en reposo más alta y niveles más altos de potasio en plasma33. Asimismo, investigaciones en animales han mostrado diferencias en el fenotipo intrínseco de los cardiomiocitos, relacionadas con los canales de calcio, entre ambos tipos de pacientes34.
¿Cuáles son las causas de la insuficiencia cardíaca?
La IC puede ser el resultado de cualquier trastorno cardíaco estructural o funcional que afecte la capacidad del ventrículo para llenarse o expulsar sangre. Así, la IC puede estar causada por enfermedades que afectan al pericardio, el miocardio, el endocardio, las válvulas cardíacas, el sistema vascular o el metabolismo35. Las causas más frecuentes de IC se muestran en la Tabla 1.
Tabla 1. Causas de insuficiencia cardíaca y formas frecuentes de presentación clínica
| Causa | Ejemplos de presentación |
| Cardiopatía coronaria | Infarto de miocardio Angina o «equivalente anginoso» Arritmias |
| Hipertensión | IC con función sistólica preservada Hipertensión maligna/edema agudo de pulmón |
| Valvulopatía | Valvulopatía primaria (por ejemplo, estenosis aórtica) Valvulopatía secundaria (por ejemplo, regurgitación funcional) Valvulopatía congénita |
| Arritmias | Taquiarritmias supraventriculares Arritmias ventriculares |
| Cardiomiopatía | Todas Dilatada Hipertrófica Restrictiva Displasia o cardiopatía arritmogénica del ventrículo derecho Periparto Síndrome Tako-Tsubo Toxinas, alcohol, cocaína, hierro, cobre |
| Infecciones | Miocarditis viral Enfermedad de Chagas Virus de la inmunodeficiencia humana Enfermedad de Lyme |
| Inducida por fármacos
|
Antraciclinas Trastuzumab Inhibidores del factor de crecimiento vascular endotelial Inhibidores de puntos de control inmunitario Inhibidores del proteasoma Inhibidores de MEK+BRAF |
| Infiltrativas | Amiloidosis Sarcoidosis Neoplasias |
| Enfermedades por depósito | Hemocromatosis Enfermedad de Fabry Enfermedad por depósito de glucógeno |
| Enfermedad endomiocárdica | Radioterapia Fibrosis/eosinofilia endomiocárdica Carcinoide |
| Enfermedad pericárdica | Calcificada Infiltrativa |
| Causas metabólicas | Enfermedad endocrina Enfermedad nutricional (tiamina, vitamina B1 y deficiencias de selenio) Enfermedad autoinmune |
| Enfermedad neuromuscular | Ataxia de Friedreich Distrofia muscular |
IC: insuficiencia cardíaca.
Fuente: McDonagh et al., 20224.
Insuficiencia cardíaca derecha e izquierda
A menudo se hace referencia a la IC como IC izquierda cuando es causada principalmente por patologías que afectan al lado izquierdo del corazón, entre ellas la disfunción del VI, de la válvula mitral o de la válvula aórtica.
La IC derecha está producida por patología que afecta al lado derecho del corazón, como por ejemplo la hipertensión pulmonar o la disfunción de la válvula pulmonar o de la válvula tricúspide. Ambos tipos de IC pueden aparecer de forma independiente o simultánea; de hecho, la IC izquierda es una causa frecuente de IC derecha y la mayoría de los pacientes con IC derecha presentan algún elemento característico de IC izquierda5.
Causas miocárdicas
Con relación a las causas miocárdicas de la IC, hay dos mecanismos miocárdicos fisiopatológicos básicos que reducen el gasto cardíaco y, por tanto, producen insuficiencia cardíaca: son la disfunción sistólica y diastólica35.
En este sentido, la IC-FEc también se conoce como IC diastólica en pacientes con una FEVI ≥50 %35. Las causas más frecuentes de IC diastólica son la hipertensión, la cardiopatía isquémica, la diabetes, la miocardiopatía hipertrófica obstructiva y la miocardiopatía restrictiva 35.
Por su parte, la IC-FEr (FEVI ≤40 %) también se conoce como IC sistólica. Entre las causas más frecuentes de disfunción sistólica figuran la cardiopatía isquémica (con una prevalencia de hasta un 62 %36), la miocardiopatía dilatada idiopática, la hipertensión y las valvulopatías, si bien es cierto que el tratamiento eficaz de la hipertensión ha dado lugar a un patrón cambiante en la prevalencia de las diferentes causas36,37.
Entre las causas más frecuentes de IC-FEr figuran la cardiopatía isquémica, la miocardiopatía dilatada idiopática, la hipertensión y las valvulopatías38.
¿Cuáles son sus manifestaciones clínicas?
En general, los síntomas de la IC son los derivados de la reducción del gasto cardíaco (fatiga, debilidad), que se hace más pronunciada con el esfuerzo, así como de la acumulación excesiva de líquido (disnea, ortopnea, edema maleolar, dolor por congestión hepática y malestar abdominal debido a la distensión por ascitis). La retención de líquidos en la IC se inicia por la disminución del gasto cardíaco, que conduce a alteraciones en la función renal secundarias a la activación tanto de los sistemas renina-angiotensina-aldosterona (que retienen sodio) como del sistema nervioso simpático. Por su parte, los pacientes con IC-FEr pueden presentar una variedad de signos y síntomas, aunque ninguno es completamente sensible o específico para el diagnóstico39. El tipo de síntomas puede proporcionar información útil sobre la naturaleza aguda o crónica de la IC5.
Formas de presentación aguda
Las formas de presentación aguda de la IC (días/semanas) se caracterizan principalmente por la dificultad para respirar (disnea) en reposo y/o con el esfuerzo5.
La disnea es el síntoma de presentación más común de la IC y puede manifestarse de diversas formas, ya sea con el esfuerzo únicamente, o en reposo y con el esfuerzo40.
A medida que la IC avanza, los pacientes con frecuencia desarrollan síntomas como disnea o fatiga en reposo o con un esfuerzo mínimo que limita su capacidad de realizar ejercicio. La gravedad de estos síntomas se clasifica en diferentes categorías funcionales según la New York Heart Association (NYHA)41, que se describen en la Tabla 2. También son comunes síntomas como la ortopnea (disnea en decúbito supino) y la disnea paroxística nocturna. La bendopnea, definida como la dificultad del paciente para respirar al inclinarse hacia adelante (por ejemplo, al calzarse), también es un síntoma indicativo de IC42. Este síntoma aparece en aproximadamente el 30 % al 50 % de los pacientes con IC (independientemente de la afectación de la fracción de eyección) y se asocia con una mayor elevación de las presiones de llenado al adoptar esta postura43.
Tabla 2. Clasificación funcional de la New York Heart Association basada en la gravedad de los síntomas y la actividad física
| Clase I | Sin limitación de actividad física. La actividad física ordinaria no causa dificultad para respirar, fatiga o palpitaciones excesivas. |
| Clase II | Ligera limitación de la actividad física. Se siente cómodo en reposo, pero la actividad física ordinaria produce dificultad para respirar, fatiga o palpitaciones excesivas. |
| Clase III | Marcada limitación de la actividad física. Se siente cómodo en reposo, pero una actividad menor que la habitual produce dificultad para respirar, fatiga o palpitaciones excesivas. |
| Clase IV | Incapacidad para realizar cualquier actividad física sin molestias. Los síntomas en reposo pueden estar presentes. Si se realiza alguna actividad física, el malestar aumenta. |
Fuente: Russel et al., 201941
Los pacientes con IC avanzada generalmente presentan síntomas de clase funcional III o IV. Aunque la capacidad de ejercicio varía según factores individuales, como la edad y el nivel de actividad, un punto de referencia útil para estimar la limitación del ejercicio es la incapacidad de caminar una manzana o realizar actividades de la vida diaria (como bañarse o vestirse) sin síntomas limitantes3.
Además de la disnea, también pueden estar presentes, aunque que son más inespecíficos, otros síntomas de IC derecha, como distensión abdominal, saciedad temprana y malestar en el hipocondrio derecho debido a congestión hepática aguda, que puede confundirse con colecistitis aguda39. Los pacientes con taquiarritmias auriculares y/o ventriculares pueden quejarse de palpitaciones con grados variables de repercusión clínica5.
Formas de presentación crónica
En cambio, en las formas de presentación crónica de la IC (meses) predominan los síntomas como la fatiga, la anorexia, la distensión abdominal y el edema periférico44.
A diferencia de las formas de presentación aguda, estos síntomas pueden ser más pronunciados que la disnea, que en este caso es más sutil y asociada al esfuerzo44.
La anorexia es secundaria a varios factores, entre ellos la mala perfusión de la circulación esplácnica, el edema intestinal y las náuseas inducidas por la congestión hepática. Esta anorexia a menudo va acompañada de pérdida de peso involuntaria e, incluso, caquexia (pérdida de tejido magro y grasa), una complicación común de la IC avanzada45 que también puede ocurrir a pesar de una ingesta calórica adecuada por desequilibrios catabólicos/anabólicos5.
También se observa con frecuencia un empeoramiento de la función renal y una diuresis inadecuada, especialmente en etapas avanzadas de la enfermedad. Los pacientes con IC crónica a menudo desarrollan hipertensión pulmonar secundaria, que puede contribuir a la disnea a medida que la presión pulmonar aumenta con el esfuerzo. Estos pacientes también pueden manifestar sensación opresiva torácica subesternal, típica de la angina5.
Algunos pacientes con IC crónica pueden experimentar un inicio relativamente rápido de sobrecarga de volumen acompañada de la elevación de las presiones de llenado cardíaco y empeoramiento de los síntomas y signos crónicos de IC (también llamada descompensación aguda)3,4. Los factores que contribuyen a la descompensación aguda varían según las características de la cohorte estudiada, y hasta en el 50 % de los pacientes se desconocen. No obstante, existe evidencia de que pudieran estar implicados factores como la hipertensión mal controlada (13 %), la fibrilación auricular con frecuencia cardíaca rápida (9 %), la falta de adherencia al tratamiento médico o restricciones dietéticas (por ejemplo, de sodio) (13 %) u otros factores estresantes (como por ejemplo anemia, infección, disfunción tiroidea o el uso de antiinflamatorios no esteroideos)46.
Las manifestaciones frecuentes de la IC incluyen disnea, fatiga e intolerancia al ejercicio5.
Diagnóstico
¿Cómo se diagnostica la insuficiencia cardíaca?
El diagnóstico temprano de la IC puede desempeñar un papel clave para facilitar el inicio rápido de tratamientos que reduzcan la carga de la enfermedad. No obstante, llegar al diagnóstico de la IC supone un desafío por la falta de un consenso claro sobre cómo se deben definir los distintos subtipos de IC o el sobrediagnóstico de IC, ya que diversas enfermedades comparten sus síntomas y signos47.
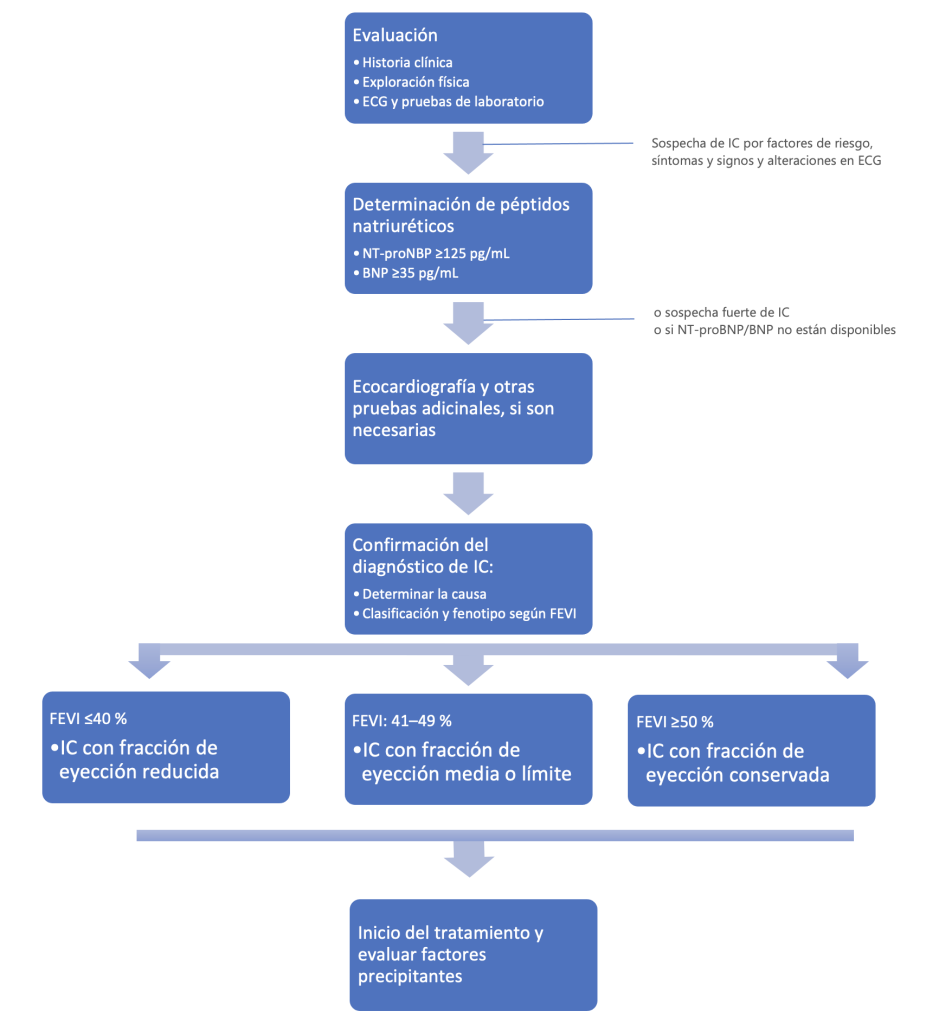
El abordaje del paciente con sospecha de IC incluye la anamnesis y la exploración física, así como el desarrollo de pruebas complementarias para ayudar a confirmar el diagnóstico, evaluar la gravedad de la enfermedad y determinar la etiología subyacente. El diagnóstico de IC-FEc puede ser más difícil, debido a la presencia de una FE normal; a continuación, nos centraremos en el diagnóstico de la IC-FEr. En la Figura 1 se muestra un algoritmo para el diagnóstico de pacientes con sospecha de IC.
Figura 1. Algoritmo diagnóstico para pacientes con sospecha de insuficiencia cardíaca
Fuente: Elaborado a partir de McDonagh et al. (2021)4 y Heidenreich et al. (2022)7
Anamnesis
El diagnóstico de IC-FEr requiere la presencia de uno o más síntomas con o sin signos físicos asociados a la IC. Por ello, investigar sobre la presencia de síntomas y signos típicos como los descritos en la Tabla 2 es fundamental a la hora de establecer el diagnóstico4. No obstante, ningún síntoma o signo por sí solo puede ayudarnos a determinar si un paciente tiene algún subtipo concreto de IC, ya que, aunque algunos síntomas o signos podrían ser más frecuentes en un tipo de IC que en el otro, se pueden observar en ambos tipos de IC48.
Además del tipo de síntoma, la historia y la forma de presentación clínica también pueden ser útiles para identificar la etiología de la IC: por ejemplo, la angina de esfuerzo podría orientar hacia una cardiopatía isquémica; la hipertensión prolongada o el consumo de alcohol, hacia una miocardiopatía hipertensiva o inducida por el alcohol; y los síntomas de infección respiratoria viral, hacia una miocarditis viral5.
Tabla 3. Evaluación inicial para diagnosticar síntomas de insuficiencia cardíaca con fracción de eyección reducida
| Síntomas típicos | Síntomas menos típicos |
| Disnea/falta de aire | Tos nocturna |
| Ortopnea | Distensión abdominal |
| Disnea paroxística nocturna | Sibilancias |
| Fatiga, cansancio, mayor tiempo para recuperarse después del ejercicio | Saciedad precoz |
| Reducción de la tolerancia al ejercicio | Bendopnea |
| Edema maleolar | Pérdida de apetito |
| Confusión (especialmente en ancianos) | |
| Depresión | |
| Palpitaciones | |
| Mareo | |
| Síncope |
Fuente: Elaborado a partir de McDonagh et al. (2021)4 y Murphy et al. (2020)39
La identificación de los síntomas de IC es un paso clave en el diagnóstico. La anamnesis detallada sigue siendo el mejor discriminador para determinar la etiología y progresión y la naturaleza aguda o crónica de la IC, además de ser de gran ayuda para orientar sus causas4.
Exploración física
El examen físico puede proporcionar signos de la presencia y magnitud de la afectación de la presión de llenado cardíaco, sobrecarga de volumen, agrandamiento ventricular, hipertensión pulmonar y reducción del gasto cardíaco. Algunos de los hallazgos de la exploración física de la IC, si bien no son muy específicos por sí solos, sí lo son cuando aparecen en el contexto típico de IC40.
No obstante, su sensibilidad para el diagnóstico es baja, por lo que la ausencia de hallazgos físicos no excluye la IC5.
La presencia de un impulso apical desplazado ha demostrado la mejor combinación de sensibilidad, especificidad y valor predictivo positivo y negativo en comparación con el resto de los signos físicos de IC-FEr49. La congestión pulmonar, el edema periférico y la presión venosa yugular elevada son las tres principales manifestaciones de la sobrecarga de volumen. Sin embargo, otros hallazgos típicos de IC, como los estertores pulmonares o el edema periférico, pueden no estar presentes en pacientes con IC-FEr, debido a mecanismos de regulación positiva compensatoria del drenaje linfático, incluso cuando la presión de enclavamiento de los capilares pulmonares está elevada39.
Además, la exploración física también ayuda a identificar signos que sugieren causas particulares de IC como, por ejemplo, soplos cardíacos que orienten a disfunción valvular primaria en un paciente con un soplo cardíaco; púrpura periorbitaria o neuropatía periférica que sugieran tipos específicos de miocardiopatías; o tríadas clásicas como la «diabetes bronce» (cirrosis, diabetes mellitus y pigmentación de la piel), que orienta a hemocromatosis tardía5.
Tabla 4. Evaluación inicial para diagnosticar signos de insuficiencia cardíaca con fracción de eyección reducida
| Signos más específicos | Signos menos específicos |
| Presión venosa yugular elevada | Aumento de peso (>2 kg/semana) |
| Reflujo hepatoyugular | Estertores y crepitantes pulmonares |
| Tercer ruido cardíaco (S3) (ritmo galope) | Edema periférico (maleolar, sacro, escrotal) |
| Impulso apical desplazado lateralmente | Ascitis |
| Extremidades frías y moteadas | |
| Disminución de la presión de pulso proporcional (relación sanguínea sistólica ≤0.25) | |
| Murmullo de regurgitación valvular o estenosis | |
| Pérdida de peso (caquexia) (IC avanzada) | |
| Efusión pleural | |
| Taquicardia | |
| Taquipnea | |
| Pulso irregular | |
| Respiración de Cheyne-Stokes | |
| Oliguria | |
| Hepatomegalia |
Fuente: Elaborado a partir de McDonagh et al. (2021)4 y Murphy et al. (2020)39
La exploración física puede revelar signos de hipertrofia ventricular, hipertensión pulmonar y reducción del gasto cardíaco, así como ayudar al diagnóstico etiológico de la IC49.
Pruebas diagnósticas iniciales
La anamnesis y exploración física proporcionan información muy importante de cara al diagnóstico. Sin embargo, puesto que los síntomas y signos por sí solos no son lo suficientemente precisos para confirmarlo, con frecuencia es necesario recurrir a herramientas adicionales para diagnosticar correctamente la IC-FEr50.
Cuando se sospecha un diagnóstico de IC-FEr, las pruebas iniciales implican análisis de sangre básicos, electrocardiograma (ECG) y radiografía de tórax, mientras que el diagnóstico de confirmación precisa de la determinación de péptidos natriuréticos, ecocardiograma y estudio de coronariopatías4.
Pruebas de laboratorio
La analítica sanguínea inicial recomendada en pacientes con síntomas y signos de IC incluyen51:
- Un hemograma completo, que pueda sugerir comorbilidades que pudieran estar exacerbando una IC preexistente, como la anemia o infección.
- Un estudio bioquímico con:
- Electrolitos séricos (incluidos calcio y magnesio), nitrógeno ureico en sangre y creatinina. Aunque la hiponatremia generalmente indica IC grave, en ocasiones puede deberse a una diuresis excesiva.
- Perfil hepático, para evaluar la función y posible afectación hepática.
- Glucemia en ayunas, para detectar diabetes mellitus
- Perfil lipídico, para detectar trastornos lipídicos.
- Hormona estimulante de la tiroides (TSH), ya que tanto el hipertiroidismo como el hipotiroidismo pueden precipitar la IC.
Electrocardiograma
La evaluación de los pacientes con sospecha de IC debe incluir un ECG de 12 derivaciones, ya que la mayoría de los pacientes con IC-FEr tienen alteraciones significativas en el ECG. De hecho, un ECG normal hace que la disfunción sistólica del VI sea poco probable (98 % de valor predictivo negativo)52.
Las alteraciones en el ECG que aparecen frecuentemente en pacientes con IC son fibrilación/aleteo auricular, trastornos de la conducción, hipertrofia ventricular izquierda, ondas Q patológicas, alteraciones del segmento ST-T y bloqueo de rama izquierda4,53.
Además, el ECG puede ser de gran ayuda para5:
- Investigar la presencia de causas específicas de IC. En este sentido, el ECG es especialmente importante para identificar signos de infarto agudo de miocardio, actual o previo, o isquemia aguda (alteraciones del segmento ST-T, ondas Q), entre otras causas como la cardiopatía amiloide (ECG de bajo voltaje) o la hipertensión arterial (signos en ECG de hipertrofia ventricular izquierda y sobrecarga sistólica).
- Detectar arritmias que sugieren enfermedad cardíaca y pueden causar o exacerbar la IC, como fibrilación auricular, latidos ventriculares prematuros asintomáticos, episodios de taquicardia ventricular no sostenida o fibrilación auricular.
Radiografía de tórax
Una radiografía de tórax puede proporcionar signos de IC, como redistribución vascular hacia campos pulmonares o cardiomegalia. Ambos signos se consideran sensibles para el diagnóstico de IC cuando aparecen de forma aislada (81 % y 64 %‑79 %, respectivamente). Cuando aparecen de forma conjunta con otros signos como líneas B de Kerley, edema alveolar o derrames pleurales bilaterales tienen una especificidad del 95 % o más54. No obstante, hay que tener en cuenta que aproximadamente 1 de cada 5 pacientes con IC aguda no presentan signos de congestión en la radiografía de tórax 54. Además, la radiografía de tórax también puede usarse para investigar otras causas potenciales de disnea, en particular enfermedades pulmonares40.
Diagnóstico de confirmación
Ecocardiografía
La ecocardiografía está recomendada en todos los pacientes con síntomas de IC para evaluar la FE, la función diastólica, el tamaño auricular y ventricular, el espesor de la pared ventricular, valvulopatías, así como la presencia de alteraciones de la motilidad parietal, hipertrofia excéntrica y concéntrica del ventrículo izquierdo, hipertensión pulmonar y marcadores de función diastólica3,4.
Además de proporcionar información importante sobre el tamaño y la función ventricular, la ecocardiografía también puede detectar otros signos importantes, como alteraciones de la pared ventricular (sugerentes de isquemia o miocardiopatía dilatada idiopática), engrosamiento pericárdico (pericarditis constrictiva), valvulopatías o derivaciones interauriculares e interventriculares, entre otras55.
En pacientes con IC-FEr, la ecocardiografía transtorácica es necesaria para confirmar el diagnóstico mediante la identificación de disfunción sistólica del ventrículo izquierdo (FEVI ≤40 %), con una sensibilidad y especificidad para el diagnóstico de disfunción sistólica de hasta el 80 % y el 100 %, respectivamente56.
La ecografía transtorácica permite estimar la presión de enclavamiento capilar pulmonar mediante la relación (E/Ea o E/E’). Esta relación suele considerarse el primer paso al evaluar la función diastólica, de forma que un índice E/e′ medio ≥15 en reposo (presión de enclavamiento capilar pulmonar media/alta) hace más probable el diagnóstico de IC-FEc. Sin embargo, este índice está sujeto a limitaciones57 y debe valorarse dentro de una evaluación ecocardiográfica integral para el diagnóstico de IC40.
Aunque el ecocardiograma no establece por sí solo el diagnóstico, es útil para identificar signos compatibles con IC, así como para identificar causas potenciales como disfunción ventricular sistólica o diastólica y/o disfunción valvular56.
Péptidos natriuréticos
En pacientes con síntomas sugerentes de IC está recomendada la determinación de los niveles de péptidos natriuréticos para diagnosticar IC, evaluar su gravedad y ayudar con el pronóstico y la estratificación del riesgo4.
Los péptidos natriuréticos ―el péptido natriurético tipo B (BNP) y su precursor, el propéptido natriurético tipo B N-terminal (NT-proBNP)― son los biomarcadores más utilizados en la IC. Se producen por la escisión en los cardiomiocitos normales de una molécula precursora (proBNP), y su producción y liberación a la circulación se eleva cuando aumentan las presiones intracardíacas, debido al consecuente estrés de la pared ventricular transmural y la elongación de los cardiomiocitos58.
Sin embargo, existen otras causas que aumentan (como la edad avanzada y enfermedad renal aguda o crónica59, entre otras que se muestran en la Tabla 5) o disminuyen (como la obesidad y la pericarditis constrictiva60) los péptidos natriuréticos en ausencia de IC, lo cual podría reducir su precisión diagnóstica, especialmente en pacientes jóvenes, con ritmo sinusal y obesidad y/o función renal normal. En este contexto, los valores de referencia establecidos en situaciones no agudas son de 35 pg/ml para BNP y 125 pg/ml para NT-proBNP, ya que estos valores tienen un valor predictivo negativo muy alto (de 94 % a 98 %) y valores por debajo de estos niveles hacen que el diagnóstico de IC sea muy improbable4. Sin embargo, cabe señalar que, para la misma clase funcional de la NYHA, los niveles de péptido natriurético son mayores en pacientes con IC-FEr que en pacientes con IC-FEc61, por lo que se deben considerar niveles más altos de péptido natriurético para descartar el diagnóstico en estas poblaciones.
Tabla 5. Causas de elevación de los péptidos natriuréticos
| Causas cardíacas | Insuficiencia cardíaca |
| Síndrome coronario agudo | |
| Miocarditis | |
| Embolia pulmonar | |
| Hipertrofia del ventrículo izquierdo | |
| Cardiomiopatía hipertrófica o restrictiva | |
| Valvulopatía | |
| Cardiopatía congénita | |
| Taquiarritmias auriculares y ventriculares | |
| Contusión cardíaca | |
| Cardioversión, choque de DCI | |
| Enfermedad pericárdica | |
| Lesiones miocárdicas tóxico-metabólicas, incluida la quimioterapia | |
| Procedimientos quirúrgicos con implicación cardíaca | |
| Hipertensión pulmonar | |
| Causas no cardíacas | Edad avanzada |
| Accidente cerebrovascular isquémico | |
| Hemorragia subaracnoidea | |
| Disfunción renal | |
| Disfunción hepática (principalmente cirrosis hepática con ascitis) | |
| Síndrome paraneoplásico | |
| EPOC y síndrome de apnea del sueño | |
| Infecciones graves (incluida la neumonía y la sepsis) | |
| Quemaduras graves | |
| Anemia | |
| Anormalidades metabólicas y hormonales graves (por ejemplo, tirotoxicosis, cetosis diabética) |
DCI: Desfibrilador cardíaco implantable; EPOC: Enfermedad pulmonar obstructiva crónica.
Fuente: Elaborado a partir de McDonagh, et al. (2021) 4 y Heidenreich et al. (2022)7
Los niveles de péptidos natriuréticos deben interpretarse en contexto junto con otros datos clínicos y no deben usarse de forma aislada para diagnosticar o excluir la IC 59.
Angiografía coronaria
Dado que aproximadamente la mitad de los casos de IC-FEr son de etiología isquémica62, los pacientes con un nuevo diagnóstico generalmente requieren un estudio de coronariopatía39.
La angiografía coronaria es la prueba estándar para la identificación de enfermedad arterial coronaria epicárdica obstructiva, aunque en pacientes con baja probabilidad de aterosclerosis coronaria se pueden considerar pruebas no invasivas, como la angiografía por tomografía computarizada coronaria39.
No obstante, antes de hacer una angiografía coronaria se deben considerar otros factores específicos del paciente, como la edad avanzada, la presencia de múltiples comorbilidades graves o la elección de no someterse a procedimientos de revascularización coronaria39. Además de definir la anatomía de las arterias coronarias, esta prueba puede proporcionar otra información útil para evaluar la gravedad de la enfermedad (gasto cardíaco, grado de disfunción del ventrículo izquierdo y presión telediastólica) y detectar derivaciones/anomalías intracardíacas y arteriales.
Otras herramientas útiles para el diagnóstico
Aunque el diagnóstico de IC puede realizarse en la mayoría de los pacientes mediante la historia clínica, la exploración física, la analítica y la ecocardiografía, es posible que se necesiten pruebas de confirmación adicionales cuando el diagnóstico no está claro.
Resonancia magnética cardíaca y otras pruebas de imagen
Para el estudio visual de la coronariopatía en pacientes con IC se pueden utilizar la tomografía computarizada o la resonancia magnética cardiovascular. Ambas pruebas han demostrado ser un enfoque prometedor para distinguir de forma no invasiva entre miocardiopatía isquémica y no isquémica. La resonancia magnética puede resultar útil en casos de diagnóstico dudoso de IC o cuando se sospecha una etiología particular. Esta prueba proporciona información relevante sobre la estructura y función cardíaca, permite la caracterización del tejido y podría facilitar el diagnóstico temprano de IC-FEc, aunque el principal problema es su disponibilidad en la práctica clínica63.
En determinados pacientes pueden estar indicadas otras pruebas de imagen cardíacas adicionales, como la tomografía por emisión de positrones, la ecografía pulmonar o la gammagrafía con pirofosfato de 99mtecnecio, especialmente para identificar ciertas causas subyacentes, pero menos comunes, de IC-FEr, como sarcoidosis, miocarditis o amiloidosis39 .
Biopsia endomiocárdica5
La biopsia endomiocárdica se recomienda en escenarios clínicos en los que los datos clínicos disponibles de otras pruebas no son concluyentes o en los que se considera que su valor diagnóstico y pronóstico (rendimiento previsto del procedimiento y disponibilidad de una terapia eficaz) supera los riesgos del procedimiento, como por ejemplo en pacientes con IC fulminante (IC de nueva aparición sin causa justificada de menos de dos semanas de evolución con compromiso hemodinámico) y en pacientes con bloqueo auriculoventricular temprano, arritmias o IC refractaria (IC de nueva aparición sin causa justificada de dos semanas de evolución).
Prueba de esfuerzo5
Aunque no se requiere una prueba de esfuerzo hemodinámico (cateterismo del corazón derecho con presión de enclavamiento capilar pulmonar en reposo y con el ejercicio) para la evaluación diagnóstica de la mayoría de los pacientes con sospecha de IC, en determinados pacientes con sospecha y diagnóstico incierto a pesar de haber realizado las pruebas descritas anteriormente, esta prueba es útil como estándar de oro clínico para realizar o excluir el diagnóstico de IC. En pacientes con síntomas compatibles de IC y valores de presión de enclavamiento capilar pulmonar ≥15 mmHg en reposo o ≥25 mmHg durante el ejercicio, se confirma el diagnóstico de IC, independientemente de la FEVI.
Otros estudios 5
En determinados pacientes, en función de los resultados del estudio inicial pueden ser necesarias otras pruebas, como la detección del virus de la inmunodeficiencia humana, serologías virales y anticuerpos antimiosina (miocarditis), ferritina y capacidad total de unión de hierro (hemocromatosis hereditaria), anticuerpos antinucleares y otras pruebas serológicas (lupus y otras enfermedades reumatológicas), niveles de tiamina, carnitina y selenio o incluso pruebas y asesoramiento genético (miocardiopatía familiar).
¿Cuál es el diagnóstico diferencial?
A la hora de establecer el diagnóstico de IC se han de tener en cuenta otras enfermedades que comparten síntomas cardinales y pueden simular IC. Se deben descartar estas comorbilidades o, al menos, determinar su contribución a la sintomatología64. Entre ellas destacan las siguientes 5:
- Otras causas de disnea, incluidas la cardiopatía isquémica, las enfermedades pulmonares y otros trastornos. Es importante investigar si la disnea tiene un origen respiratorio o cardíaco. La enfermedad pulmonar obstructiva crónica es frecuente en pacientes con IC (hasta el 40 %)65 y puede resultar difícil determinar la contribución relativa de cada una a la carga de síntomas y al estado funcional. La prueba de ejercicio cardiopulmonar puede ser útil en este sentido.
- Otras causas de fatiga, como la falta de condición física, la apnea del sueño y la depresión.
- Otras causas de retención de líquidos, como la trombosis o insuficiencia venosa, la retención renal de sodio, los efectos secundarios del tratamiento con ciertos fármacos (como los calcioantagonistas) y la cirrosis. Con respecto a esa última, la presencia de una presión venosa yugular normal en el examen físico de un paciente con ascitis puede ser útil para atribuir la ascitis a una causa no cardíaca. Sin embargo, es importante reconocer que la IC derecha crónica y la presión venosa central elevada también pueden provocar cirrosis, y que la IC avanzada y la cirrosis pueden coexistir.
Además de las descritas, es importante establecer el diagnóstico diferencial con otras patologías, como miocardiopatías infiltrativas (amiloidosis), causas de hipertensión pulmonar no debida a IC, pericarditis constrictiva, miocardiopatía hipertrófica, sarcoidosis cardíaca, obesidad, diabetes, fibrilación auricular (aproximadamente 40 % en el momento del diagnóstico) y anemia66.
Tratamiento
¿Cuál es el tratamiento de la insuficiencia cardíaca?
El tratamiento de la IC se guía por el grado de afectación de la FEVI, que ha demostrado predecir los resultados incluso en ausencia de síntomas67. A continuación, nos centraremos en la descripción general del tratamiento de los pacientes con IC-FEr crónica.
Los tres principales objetivos del tratamiento de la IC-FEr son reducir la mortalidad, mejorar la calidad de vida relacionada con la salud del paciente y su estado funcional y prevenir las hospitalizaciones recurrentes debido al empeoramiento de la IC47.
Para ello, el tratamiento de la IC-FEr incluye el tratamiento de la causa de la IC y las posibles comorbilidades asociadas, el seguimiento y prevención de complicaciones, la coordinación de la atención, la educación y asesoramiento del paciente y sus cuidadores para el autocontrol de la IC (modificación del estilo de vida y seguimiento diario), la terapia farmacológica, la rehabilitación cardíaca, los cuidados paliativos, el tratamiento con dispositivos (como la terapia de resincronización cardíaca y el desfibrilador automático implantable) y el trasplante cardíaco 4.
Los objetivos del tratamiento de la IC-FEr son mejorar los síntomas, el estado funcional y la calidad de vida relacionada con la salud del paciente, así como disminuir el riesgo de hospitalización y la mortalidad4.
Educación del paciente y cambios en los hábitos de vida
La educación del paciente y el apoyo para promover su autocontrol es fundamental a la hora de abordar la IC. El autocontrol de la IC incluye el control de la medicación, el seguimiento diario de signos y síntomas (incluido el peso, para detectar la acumulación de líquidos) y la modificación de los hábitos de vida. Las principales recomendaciones sobre los hábitos de vida incluyen3,4:
-
Evitar el consumo excesivo de sal (no más de 5 g/día4) o restringir la ingesta a <3 g/día de sodio en pacientes con IC sintomática3.
- Dejar de fumar, restringir o abstenerse del consumo de alcohol y evitar el consumo de
- Practicar ejercicio de manera habitual, adecuado a la situación funcional del paciente, y evitar los hábitos sedentarios y la obesidad.
- Restringir la ingesta de líquidos a 1,5-2 l/día, recomendado solo en pacientes con IC refractaria o hiponatremia sintomática o grave (sodio sérico <120 mEq/l).
Tratamiento farmacológico
Las recomendaciones de las principales guías de práctica clínica4,68,69 abogan por un tratamiento médico basado en la terapia cuádruple fundamental, que consiste en una combinación de un inhibidor de la enzima convertida de la angiotensina (IECA) (o una combinación de antagonista de los receptores del sistema renina-angiotensina-aldosterona/inhibidor del receptor de angiotensina-neprilisina-ARNI-), un β-bloqueante (BB), un antagonista de los receptores de mineralocorticoides (ARM) y un inhibidor del cotransportador 2 de glucosa y sodio (iSGLT-2), a menos que estén contraindicados o no se toleren. Los antagonistas del receptor de la angiotensina II (ARA-II) siguen siendo útiles para los pacientes que no toleran el tratamiento con un IECA o un INRA.
Además, los pacientes con IC-FEr también pueden ser candidatos a recibir diversas terapias con dispositivos, como desfibriladores automáticos implantados (DAI), terapia de resincronización cardíaca (TRC), reparación de la válvula mitral transcatéter o la monitorización sin cables de la presión de la arteria pulmonar70.
A continuación, se detalla cada uno de estos grupos farmacológicos, así como otras terapias farmacológicas en grupos de pacientes específicos que se detallan en el epígrafe correspondiente.
El tratamiento médico recomendado para tratar la IC-FEr se basa en una combinación de un IECA/ARNI, un betabloqueante, un ARM y un iSGLT-24.
Inhibidores de la enzima convertida de la angiotensina (IECA)
Los IECA previenen la conversión de angiotensina I en angiotensina II. Los principales fármacos de este grupo recomendados en pacientes con IC-FEr son captopril (50 mg/8 h), enalapril (10-20 mg/12 h), lisinopril (20-35 mg/24 h), ramipril (5 mg/24 h) y trandolapril (4 mg/24 h) y están recomendados en todos los pacientes con IC-FEr (a menos que estén contraindicados) para reducir el riesgo de hospitalización y muerte por IC, además de mejorar los síntomas. El tratamiento se inicia en dosis bajas y se va aumentando según la respuesta hasta alcanzar las dosis objetivo4.
Deben usarse con precaución en pacientes con presión arterial baja (presión arterial sistólica <80 mmHg), enfermedad crónica renal (creatinina >3,0 mg/dl) o hiperpotasemia (potasio >5,5 mEq/l), y deben evitarse en embarazadas o mujeres con deseo gestacional y en pacientes con estenosis bilateral de la arteria renal39.
Entre los efectos secundarios de los IECA destacan la tos, hipotensión, empeoramiento de la función renal e hiperpotasemia. Aunque generalmente los pacientes con IC-FEr los toleran bien, los pacientes con enfermedad avanzada o en etapa terminal a menudo requieren una reducción o interrupción del tratamiento debido a hipotensión, empeoramiento de la función renal o hiperpotasemia71.
Inhibidores de la neprisilina y del receptor de la angiotensina (ARNI)
Estos fármacos bloquean los receptores de angiotensina I y suprimen la neprilisina, mejorando la biodisponibilidad de los péptidos natriuréticos, la bradicinina y la sustancia P y produciendo acciones natriuréticas, vasodilatadoras y antiproliferativas4.
El sacubitrilo/valsartán (97/103 mg/12 h) está indicado en pacientes con IC-FEr para reducir el riesgo de hospitalización y muerte por IC. Se ha observado que mejora los síntomas y la remodelación ventricular en pacientes con IC, disminuyendo los péptidos natriuréticos (NT-proBNP).
La Sociedad Europea de Cardiología (ESC) recomienda la transición a sacubitrilo/valsartán en pacientes ambulatorios con IC-FEr que ya toman un IECA o un ARA-II y que permanecen sintomáticos a pesar del tratamiento óptimo. También indica que se puede considerar el inicio de sacubitrilo/valsartán en pacientes con IC sin tratamiento previo con IECA (es decir, de novo), por considerarlo seguro y asociarse con un remodelado cardíaco inverso significativo, y reducir el riesgo de rehospitalización temprana en pacientes con IC aguda reciente4.
Por su parte, la guía de la AHA/ACC/HFSA propone el ARNI como primera opción de tratamiento por delante del IECA, dejando el IECA solo en caso de no existir posibilidad de tratamiento con ARNI 7.
La ESC recomienda un IECA como primera línea y sustituirlo por un INRA si persisten los síntomas, mientras que la AHA/ACC/HFSA recomienda el INRA desde el inicio 4,7.
Se requiere un período de lavado de al menos 36 h después del tratamiento con IECA para minimizar el riesgo de angioedema4.
Entre los efectos secundarios del sacubitrilo/valsartán destacan angioedema, hiperpotasemia e hipotensión sintomática. Debido a la probabilidad de angioedema, el tratamiento con ARNI no debe usarse en pacientes que hayan sufrido previamente angioedema secundario a IECA/ARAII o ARNI47.
Durante el tratamiento con ARNI, es importante realizar un seguimiento de la presión arterial, la función renal, la creatinina sérica, el potasio sérico y los electrolitos. El inicio del ARNI se tolera bien en pacientes con insuficiencia renal leve. En caso de que el aumento de la creatinina sérica sea superior al 30 % dentro de las 4 semanas posteriores al inicio del tratamiento, las dosis pueden reducirse o suspenderse brevemente para evaluar la mejora de la función renal. Una vez que la función renal mejora, se debe volver a iniciar el tratamiento con ARNI para determinar la dosis máxima tolerable47.
En personas estables, los ARNI se pueden ajustar cada 1 o 2 semanas, o más gradualmente en aquellos con presión arterial más baja. En pacientes euvolémicos, puede ser beneficioso reducir las dosis de diuréticos del asa mientras se inicia el ARNI, para mitigar la probabilidad de hipotensión47.
β-bloqueantes (BB)
Los BB van dirigidos al receptor adrenérgico; inhiben los efectos sistémicos de la activación simpática crónica y elevan el tono vagal. Han demostrado reducir la mortalidad cardiovascular y por todas las causas, la muerte cardíaca súbita y las hospitalizaciones por IC en pacientes con IC-FEr, si bien el beneficio no parece ser un efecto de clase, ya que solo se ha demostrado con BB específicos como bisoprolol (10 mg/24 h), carvedilol (25 mg/12 h) y metoprolol (200 mg/24 h)4.
Estos fármacos están recomendados en todos los pacientes con IC-FEr, salvo que estén contraindicado o no se toleren4.
Se recomienda iniciar el tratamiento con BB lo antes posible tras el diagnóstico de IC, incluso durante la primera hospitalización, siempre que el paciente esté hemodinámicamente estable y no sufra sobrecarga de volumen significativa47.
El tratamiento debe iniciarse en pacientes clínicamente estables y euvolémicos con una dosis baja y aumentarse gradualmente hasta la dosis máxima tolerada. Dado que la titulación de la dosis puede empeorar temporalmente la congestión y alterar el gasto cardíaco, el ajuste de las dosis de BB debe realizarse cada 1-2 semanas hasta alcanzar dosis efectivas y bien toleradas 4,47. Durante el ajuste se debe controlar la frecuencia cardíaca, la presión arterial y los signos de congestión para detectar retención de líquidos y empeoramiento de la IC, bradicardia o bloqueo cardíaco e hipotensión.
Deben administrarse con precaución en pacientes con bradicardia y con enfermedad reactiva sintomática de las vías respiratorias. La interrupción brusca del tratamiento con BB puede provocar deterioro clínico, por lo que debe evitarse a menos que sea absolutamente necesario47. No debe iniciarse el tratamiento con BB en pacientes con IC-FEr con sobrecarga de líquidos hasta que se alcance el estado euvolémico71. Asimismo, el tratamiento con BB debe evitarse en pacientes que desarrollan bradicardia incluso con dosis mínimas, pacientes con IC grave y shock cardiogénico o pacientes con bloqueo auriculoventricular de alto grado47.
Antagonistas de los receptores de mineralocorticoides (ARM)
Los ARM inhiben el efecto de aldosterona en los receptores de mineralocorticoides, previniendo así los efectos posteriores de la aldosterona sobre la retención de sodio y agua. Fármacos de este grupo, como la espironolactona (50 mg/24 h) y la eplerenona (50 mg/24 h), han demostrado reducir la mortalidad y el riesgo de hospitalización por IC, además de mejorar los síntomas y de reducir la hipertrofia del VI y la presión arterial71.
Se recomiendan en todos los pacientes con IC-FEr que ya están recibiendo terapia con BB e IECA4.
La administración de ARM en combinación con ARNI y BB se considera segura durante la hospitalización. Además, la administración intrahospitalaria de ARM mejora la adherencia a largo plazo más que diferir el tratamiento a pacientes ambulatorios a criterio del médico47.
Los ARM tienen poco o ningún impacto reductor de la presión arterial en las dosis utilizadas habitualmente en la práctica clínica, y pueden iniciarse de forma segura en la mayoría de los pacientes con hipotensión límite. Es necesario evaluar cuidadosamente los riesgos y hacer una estrecha vigilancia durante el inicio y el mantenimiento del tratamiento. Deben controlarse la función renal y los niveles de potasio durante la primera semana del inicio del tratamiento o del aumento de dosis, mensualmente durante los primeros 3 meses, trimestralmente durante un año y, posteriormente, cada 6 meses47.
El principal efecto secundario asociado al uso de ARM es la hiperpotasemia, especialmente cuando se usan en combinación con un IECA o un ARA. Por lo tanto, están contraindicados en pacientes con creatinina sérica >2,5 mg/dl en hombres o >2,0 mg/dl en mujeres (o con una tasa de filtración glomerular estimada <30 ml/min/1,73 m2) o un nivel de potasio >5,0 mEq/l47,71.
La espironolactona puede inducir ginecomastia, mientras que la eplerenona es más específica para el bloqueo de la aldosterona y, por tanto, provoca menos ginecomastia4.
En un estudio en la vida real, que incluyó 293 pacientes con IC-FEr, se encontró que, aunque no hubo diferencias entre la espironolactona y la eplerenona en el criterio de valoración compuesto primario (muerte por causa cardiovascular u hospitalización por IC), la eplenerona se asoció a menor mortalidad por causa cardiovascular (HR 0,55; IC95%: 0,35-0,85) y por cualquier causa (HR 0,67; IC95%: 0,47-0,95). Además, la incidencia de interrupción del tratamiento debido a los efectos adversos (HR 0,58; IC95%: 0,40-0,85) y a cualquier motivo (HR 0,70; IC95%: 0,51-0,97) fue menor entre los pacientes tratados con eplerenona72.
Inhibidores del cotransportador de sodio y glucosa de tipo 2 (iSGLT-2)
Los iSGLT-2 reducen la absorción de glucosa en el túbulo renal proximal mediante la inhibición del SGLT-2, que es un mecanismo dependiente de glucosa e independiente de insulina. Producen diuresis osmótica por glucosuria y natriuresis y se han observado efectos beneficiosos para la presión arterial y la pérdida de peso, aunque se desconoce cómo los iSGLT-2 mejoran el pronóstico de los pacientes con IC-FEr47.
Se recomiendan dapagliflozina (10 mg/24 h) o empagliflozina (10 mg/24 h) en pacientes con IC-FEr para reducir el riesgo de hospitalización y muerte por IC47.
Pueden administrarse de forma segura durante la hospitalización y puede no ser necesario ajustar la dosis inicial47.
El tratamiento con iSGLT-2 puede suspenderse temporalmente cuando el paciente experimenta hipotensión postural sintomática, cuando la creatinina sérica aumenta >30 % dentro de las 4 semanas posteriores al inicio de la terapia o cuando se detectan cetonas o niveles elevados de lactato47.
Una vez iniciado el tratamiento con iSGLT-2, se debe evaluar la función renal, los niveles de cetonas y lactato en suero/orina, la presión arterial y la presencia de cualquier infección micótica genital4.
Con respecto a su perfil de seguridad, se han observado infecciones micóticas genitales leves con uso de iSGLT-2. La gangrena de Fournier y la cetoacidosis diabética son efectos secundarios muy raros de los iSGLT-2. En pacientes en tratamiento con diuréticos se debe hacer un seguimiento de la volemia, debido al riesgo de un aumento de la diuresis. El inicio del tratamiento con iSGLT-2 se relaciona con una disminución inicial de la tasa de filtrado glomerular estimada, aunque esta disminución se considera favorable en pacientes con IC-FEr47.
Otros fármacos que considerar en pacientes seleccionados
Diuréticos
Los diuréticos bloquean el transportador de Na+/K+/Cl- en el asa de Henle y el cotransportador de Na+/Cl- en el túbulo contorneado distal del riñón, lo que provoca la pérdida de sal y agua para restaurar la euvolemia71.
La mayoría de los pacientes con IC-FEr crónica necesitan un diurético para controlar la retención de líquidos5.
Dentro de este grupo, los fármacos más utilizados son los diuréticos de asa (furosemida, bumetanida, torasemida), aunque en pacientes que desarrollan resistencia a los diuréticos se pueden agregar análogos de las tiazidas39. Los diuréticos están recomendados en pacientes con IC-FEr con signos y/o síntomas de congestión para aliviar los síntomas de IC, mejorar la capacidad de ejercicio y reducir las hospitalizaciones por IC4. La dosificación óptima de los diuréticos y la evaluación del estado del volumen son vitales para lograr la euvolemia y al mismo tiempo minimizar el riesgo de insuficiencia renal significativa71.
Los principales efectos adversos de los diuréticos son la depleción de volumen o electrolitos, así como una diuresis excesiva que puede predisponer a hipotensión y lesión renal aguda. Algunos pacientes pueden beneficiarse de un programa de dosificación de diuréticos en el que registran su peso corporal diariamente y la dosis se ajusta si el peso aumenta o disminuye más allá de un rango específico39.
Antagonistas del receptor 1 de la angiotensina II (ARA-II)
Los ARA-II inhiben el efecto de la angiotensina II sobre los receptores de angiotensina tipo 1, inhibiendo así los efectos posteriores de la angiotensina II sobre los vasos sanguíneos y la biosíntesis de aldosterona. Han demostrado reducir las muertes de causa cardiovascular y las hospitalizaciones por IC en pacientes que no estaban recibiendo un IECA debido a intolerancia previa. Sin embargo, ningún ARA-II ha demostrado reducir la mortalidad por todas las causas. Los ARA-II (como candesartán (32 mg/24 h), losartán (150 mg/24 h) y valsartán (160 mg/12 h) se recomiendan en pacientes con IC-FEr que no toleran IECA o ARNI debido a efectos secundarios graves4.
Los ARA-II deben iniciarse con una dosis baja y ajustarse hasta la dosis máxima tolerada. Durante las 2 semanas posteriores al inicio del tratamiento debe hacerse un seguimiento estrecho de la función renal y el potasio sérico71.
Su perfil de efectos adversos es similar al de los IECA, aunque hay una incidencia notablemente menor de tos y angioedema71.
Inhibidor del canal If
Los inhibidores del canal If (ivabradina) inhiben selectivamente el impulso del marcapasos If en el nódulo sinoauricular para disminuir la frecuencia cardíaca en ritmo sinusal, sin afectar la presión arterial, la contractilidad miocárdica o la conducción intracardíaca47.
La adición de ivabradina (7,5 mg/12h) al tratamiento médico habitual ha demostrado producir una reducción relativa del 18 % en el resultado compuesto de mortalidad y tasa de hospitalización por IC en pacientes con IC-FEr sintomática (FEVI ≤35 %) hospitalizados por IC, en ritmo sinusal (RS) y con frecuencia cardíaca ≥70 latidos por minuto (lpm) en tratamiento con un IECA (o ARA-II), un BB y un ARM73,74. El beneficio de la ivabradina se debió principalmente a una reducción relativa del 26 % en las hospitalizaciones por IC74.
Por tanto, el tratamiento con ivabradina está recomendado en pacientes sintomáticos con FEVI ≤35 %, en ritmo sinusal y con frecuencia cardíaca en reposo ≥70 lpm a pesar del tratamiento con BB, IECA (o ARNI) y un ARM o en aquellos con intolerancia o contraindicación para los BB, para reducir el riesgo de hospitalización por IC y muerte cardiovascular4.
Es recomendable hacer todo lo posible para comenzar y aumentar el tratamiento con BB hasta las dosis máximas recomendadas/toleradas antes de considerar el inicio de ivabradina4.
La ivabradina puede causar visión borrosa transitoria y puede inducir sensaciones luminosas visuales breves47. Está contraindicada si hay bradicardia, bloqueo cardíaco grave o enfermedad hepática grave39.
Dinitrato de hidralazina-isosorbida
El uso combinado de hidralazina y dinitrato de isosorbida induce vasodilatación al aumentar la señalización del óxido nítrico y mejora el pronóstico en pacientes de raza negra con IC-FEr. El tratamiento con estos fármacos ha demostrado reducir la mortalidad por todas las causas y la tasa de hospitalizaciones por IC en pacientes negros con IC-FEr con síntomas de clase III-IV de la NYHA39.
Se debe considerar iniciar el tratamiento con hidralazina y dinitrato de isosorbida (en dosis de inicio recomendadas de 37,5 mg/8 h y 20 mg/8 h, respectivamente) en pacientes de raza negra con FEVI ≤35 % o con una FEVI <45 % combinada con dilatación de ventrículo izquierdo en clase III-IV de la NYHA a pesar del tratamiento con un IECA (o ARNI), un BB y un ARM4.
También se puede considerar la hidralazina y el dinitrato de isosorbida en pacientes con IC-FEr sintomática que no toleran IECA, ARA-II o ARNI (o están contraindicados)4.
Entre sus efectos adversos destacan hipotensión sintomática, artralgias, erupción cutánea, fiebre y pericarditis39.
Vericiguat
El vericiguat es un estimulador oral de la guanilato-ciclasa soluble que mejora el funcionamiento de la señalización del monofosfato de guanosina cíclico (cGMP), produciendo vasodilatación y efectos antiinflamatorios. Vericiguat ha demostrado reducir la muerte por causa cardiovascular o la probabilidad de sufrir una primera hospitalización por IC47.
Se puede considerar el tratamiento con vericiguat (en dosis de inicio de 2,5 mg/24 h) en pacientes en clase II-IV de la NYHA que han empeorado la IC a pesar del tratamiento con un IECA (o ARNI), un BB y un ARM, para reducir el riesgo de mortalidad CV y hospitalización por IC4.
Entre sus efectos secundarios, vericiguat puede provocar hipotensión sintomática y síncope47.
Digoxina
Se puede considerar el tratamiento con digoxina (en dosis de inicio de 62,5 µg/24 h) en pacientes con IC-FEr sintomática en ritmo sinusal a pesar del tratamiento con un IECA (o ARNI), un BB y un ARM, para reducir el riesgo de hospitalización (tanto por todas las causas como por IC). La digoxina también puede ser útil para el tratamiento de pacientes con IC-FEr y FA con frecuencia ventricular rápida sintomática, cuando no existen otras opciones terapéuticas4.
Debido a que la digoxina tiene una ventana terapéutica estrecha, es necesario controlar los niveles con el objetivo de alcanzar una concentración sérica <1,2 ng/ml. Se debe usar con precaución en mujeres, ancianos, personas frágiles, pacientes con hipopotasemia y pacientes con desnutrición. La toxicidad por digoxina puede presentarse como arritmias cardíacas, náuseas, vómitos, alteraciones visuales, desorientación y confusión71.
Tratamiento con dispositivos médicos
Las terapias con dispositivos incluyen el desfibrilador cardíaco implantable (DCI), la terapia de resincronización cardíaca (TRC), la reparación transcatéter de la válvula mitral (tMVR) y los monitores inalámbricos de la presión de la arteria pulmonar.
La guía de la ESC indica que, si el tratamiento médico de la IC-FEr fracasa, existen las siguientes opciones4:
- FEVI ≤35 % y QRS <130 ms y hay indicación: DCI.
- FEVI ≤35 %, ritmo sinusal y QRS ≥130 ms: terapia de resincronización cardíaca con desfibrilador (TRC_D) o terapia de resincronización cardíaca con marcapasos (TRC-M).
- FEVI >35 % o falta de indicación para tratamiento con dispositivos: considerar otras terapias si los síntomas persisten.
A continuación, se resumen las principales características del tratamiento con dispositivos médicos.
Desfibrilador cardíaco implantable (DCI)
La muerte cardíaca súbita es una de las principales causas de muerte en los pacientes con IC-FEr, por lo que el DCI puede estar indicado para reducir este riesgo. El DCI ha mostrado reducir la mortalidad por todas las causas en pacientes con miocardiopatía isquémica y el riesgo de muerte cardíaca súbita en pacientes con miocardiopatía no isquémica en comparación con el tratamiento médico óptimo.
Aunque existe evidencia que apunta a que los pacientes con IC-FEr no isquémica pueden obtener una ventaja menor con este tipo de tratamiento, las guías aún recomiendan el uso del DCI como prevención primaria para reducir el riesgo de muerte súbita y mortalidad por todas las causas en pacientes con IC sintomática (clase II o III de la NYHA) en uno de los siguientes supuestos4:
- etiología isquémica (a menos que hayan tenido un infarto de miocardio en los 40 días anteriores) y FEVI ≤35 % a pesar de ≥3 meses de tratamiento médico óptimo (siempre que la supervivencia esperada sea de más de 1 año con buen estado funcional).
- etiología no isquémica y FEVI ≤35 % a pesar de >3 meses de tratamiento médico óptimo (siempre que la supervivencia esperada sea de más de 1 año con buen estado funcional).
Los pacientes deben ser evaluados por un cardiólogo experimentado antes de reemplazar el generador, porque los objetivos de manejo, las necesidades del paciente y el estado clínico pueden haber cambiado. El DCI no se recomienda en pacientes en clase IV de la NYHA con síntomas graves refractarios a la terapia farmacológica a menos que sean candidatos para TRC, un dispositivo de asistencia ventricular o un trasplante cardíaco4.
Terapia de resincronización cardíaca (TRC)
Aproximadamente un tercio de los pacientes con IC-FEr tienen una duración prolongada del intervalo QRS en el ECG que indica un grado de asincronía mecánica que se relaciona con peores resultados médicos. La terapia de resincronización cardíaca (TRC) consiste en la implantación de cables de estimulación en los ventrículos derecho e izquierdo a través del seno coronario, que están programados para estimular dentro de un intervalo que maximiza la sincronía39.
Se ha observado que el mayor beneficio en la mejora de los síntomas y reducción de la morbilidad y mortalidad de la TRC se produce en pacientes con un complejo QRS ancho (>150 milisegundos) con morfología de bloqueo de rama izquierda (BRI) y ritmo sinusal normal, aunque la TRC también se puede valorar en ciertos pacientes con una duración del QRS de 130 a 149 milisegundos y morfología sin BRI, dependiendo de criterios adicionales como la clase funcional de la NYHA, la FEVI y la etiología de la IC. La TRC no se recomienda en pacientes con una duración de QRS <130 ms que no tienen indicación de estimulación debido a un bloqueo AV de alto grado4.
Reparación transcatéter de la válvula mitral (tMVR)
La reparación transcatéter de la válvula mitral (tMVR) se ha propuesto como tratamiento para pacientes con IC-FEr que padecen insuficiencia mitral (IM) secundaria grave y ya están en tratamiento médico óptimo4.
Monitorización inalámbrica de la presión de la arteria pulmonar
Después de la hospitalización por IC aguda, se puede considerar la implantación de un monitor inalámbrico de presión de la arteria pulmonar en pacientes con síntomas persistentes de IC clase III de la NYHA para reducir la tasa de hospitalización por IC4.
Rehabilitación cardíaca
En pacientes con IC-FEr, la rehabilitación cardíaca mediante ejercicios físicos mejora la capacidad de ejercicio y la calidad de vida, además de reducir las hospitalizaciones por todas las causas y por IC, especialmente en aquellos que cumplen bien el programa de ejercicios. No obstante, persiste la incertidumbre sobre sus efectos sobre la mortalidad75.
Por tanto, el ejercicio físico está recomendado en todos los pacientes con IC crónica, siempre que puedan practicarlo, para mejorar su capacidad de ejercicio, la calidad de vida y reducir la hospitalización por IC4.
En pacientes con enfermedades más graves, fragilidad o comorbilidades se puede considerar un programa de rehabilitación cardíaca supervisado4.
La rehabilitación cardíaca se considera una terapia segura, sin un exceso de riesgo de eventos adversos cardiovasculares u hospitalización después de realizar los ejercicios. Además de los beneficios de llevar a cabo un tratamiento con ejercicios, la participación en un programa de rehabilitación cardíaca brinda una valiosa oportunidad para vigilar de forma continua de los síntomas y signos vitales, la dosificación de la medicación, la educación del paciente y el seguimiento de los trastornos del estado de ánimo39.
¿Cuál es el pronóstico de la insuficiencia cardíaca?
Si bien se han logrado avances significativos en el tratamiento de la IC-FEr, la mejora en la supervivencia parece estabilizarse durante los últimos años a pesar de una lista cada vez mayor de tratamientos que han demostrado mejorar la supervivencia39.
Los pacientes con IC-FEc tienen un pronóstico mejor que los pacientes con IC-FEr, con una mayor tasa de supervivencia76.
La mortalidad anual de los pacientes con FE preservada oscila entre el 8 % y el 12 %, con tasas de supervivencia a los 5 años de entre el 35 % y el 40 %77. El riesgo de mortalidad aumenta con cada hospitalización posterior por insuficiencia cardíaca y se estima que 5 años después de una hospitalización por IC, las tasas de rehospitalización en estos pacientes son aproximadamente del 80 %78.
La estimación del pronóstico ayuda a los pacientes y a los médicos a participar en una toma de decisiones compartida sobre el tipo y momento apropiados para comenzar el tratamiento farmacológico, así como para realizar la transición a terapias avanzadas. El pronóstico debe reevaluarse en cada visita y especialmente después de eventos importantes, como por ejemplo las hospitalizaciones por IC39.
Los signos que pueden sugerir que el paciente padece una IC avanzada son la presencia de hospitalizaciones repetidas, visitas urgentes no planificadas por descompensación de la IC u hospitalizaciones complicadas (por ejemplo, aquellas que precisan ingreso en la unidad de cuidados intensivos o el empleo de inotrópicos)79.
Factores como la reducción de la distensibilidad del VI, la remodelación del ventrículo derecho y la coexistencia de cardiopatía isquémica, diabetes mellitus e insuficiencia renal crónica afectan negativamente al pronóstico28.
Por otra parte, un índice de masa corporal (IMC) elevado, FA, niveles altos de hemoglobina glicosilada (HbA1c), así como una tasa de filtración glomerular estimada baja, son fuertes predictores de hospitalizaciones por IC4.
Para establecer el pronóstico se ha propuesto el empleo de biomarcadores como el NT-proBNP, de forma que los pacientes con concentraciones bajas (<1000 pg/ml) tienden a tener un curso más benigno con menos remodelación del ventrículo izquierdo y menos eventos; por lo tanto, podrían beneficiarse de un seguimiento o pruebas diagnósticas menos agresivas. No obstante, los pacientes que presentan signos de congestión ―como ingurgitación yugular, edema, estertores pulmonares y ritmo de galope S3― tienen mayor riesgo de muerte cardiovascular y de hospitalización por IC, independientemente de los síntomas que presenten, los niveles de péptidos natriuréticos y las estimaciones de riesgo28,39.
Otro método disponible para establecer el pronóstico es el uso de herramientas que puntúen el riesgo según múltiples variables, como el PREDICT-HF (PARADIGM Risk of Events and Death in the Contemporary Treatment of Heart Failure80), aunque su precisión para predecir el riesgo de mortalidad y hospitalización es moderada y se ha de valorar en conjunto con otras variables para determinar el pronóstico39.
La hospitalización por IC es un marcador de mal pronóstico, junto a otros como la reducción de la distensibilidad del VI, la remodelación del ventrículo derecho y la coexistencia de cardiopatía isquémica, diabetes mellitus e insuficiencia renal crónica 28.
Guías clínicas
Últimas guías publicadas
- Guía de 2022 de la AHA/ACC/HFSA para el abordaje de la IC.
https://www.sciencedirect.com/science/article/pii/S0735109721083959?via%3Dihub
Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2022 May;79(17):e263–421..
- Guía ESC 2021 sobre el diagnóstico y tratamiento de la IC aguda y crónica.
https://www.revespcardiol.org/es-guia-esc-2021-sobre-el-articulo-S0300893221005236
McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al; Grupo de Trabajo de la Sociedad Europea de Cardiología (ESC) de diagnóstico y tratamiento de la insuficiencia cardiaca aguda y crónica. Desarrollada con la colaboración especial de la Heart Failure Association (HFA) de la ESC. Guía ESC 2021 sobre el diagnóstico y tratamiento de la insuficiencia cardiaca aguda y crónica. Vol. 75, Rev Esp Cardiol. 2022; 75 (6): 523.e1-523.e114.
- Guía canadiense sobre los diferentes fenotipos de la IC.
https://www.sciencedirect.com/science/article/abs/pii/S0828282X23003719
Ducharme A, Zieroth S, Ahooja V, Anderson K, Andrade J, Boivin-Proulx L-A, et al. Canadian Cardiovascular Society-Canadian Heart Failure Society Focused Clinical Practice Update of Patients With Differing Heart Failure Phenotypes. Vol. 39, The Canadian journal of cardiology. England; 2023. p. 1030–40.
- Consenso de 2021 sobre la optimización del tratamiento farmacológico de la IC-FEr.
https://www.revportcardiol.org/pt-optimization-heart-failure-with-reduced-articulo-S0870255121003553
Silva-Cardoso J, Fonseca C, Franco F, Morais J, Ferreira J, Brito D. Optimization of heart failure with reduced ejection fraction prognosis-modifying drugs: A 2021 heart failure expert consensus paper. Revista portuguesa de cardiologia. Spain. 2021; 40: 975–83.
- Guía sobre el papel de los péptidos natriuréticos en la IC.
https://onlinejcf.com/article/S1071-9164(23)00064-7/fulltext
Tsutsui H, Albert NM, Coats AJS, Anker SD, Bayes-Genis A, Butler J, et al. Natriuretic Peptides: Role in the Diagnosis and Management of Heart Failure: A Scientific Statement From the Heart Failure Association of the European Society of Cardiology, Heart Failure Society of America and Japanese Heart Failure Society. J Card Fail. 2023 May;29(5):787–804.
- Actualización de 2021 del consenso de la ACC de 2017 sobre 10 aspectos clave de la optimización del tratamiento de la IC.
https://www.jacc.org/doi/10.1016/j.jacc.2020.11.022
Maddox TM, Januzzi JLJ, Allen LA, Breathett K, Butler J, Davis LL, et al. 2021 Update to the 2017 ACC Expert Consensus Decision Pathway for Optimization of Heart Failure Treatment: Answers to 10 Pivotal Issues About Heart Failure With Reduced Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversig. J Am Coll Cardiol. 2021 Feb;77(6):772–810.
- Guía de la AHA para tratar la FA en pacientes con IC-FEr
https://www.ahajournals.org/doi/full/10.1161/HAE.0000000000000078
Gopinathannair R, Chen LY, Chung MK, Cornwell WK, Furie KL, Lakkireddy DR, et al. Managing atrial fibrillation in patients with heart failure and reduced ejection fraction: a scientific statement from the American Heart Association. Circulation: Arrhythmia and Electrophysiology. 2021; 14 (7): e000078.
- Consenso de la HFSA, ESC y JHFS sobre la definición y clasificación de la IC.
Bozkurt, Biykem, et al. Universal definition and classification of heart failure: a report of the heart failure society of America, heart failure association of the European society of cardiology, Japanese heart failure society and writing committee of the universal definition of heart failure. Journal of cardiac failure. 2021; 387-413.
- Guía de la NICE sobre el diagnóstico y tratamiento de la IC crónica en adultos.
https://www.nice.org.uk/guidance/ng106
National Institute for Health and Care Excellence. Chronic heart failure in adults: diagnosis and management. Guideline [NG106]. 2018.
- Guía de la Japanese Circulation Society (JCS)/JHFS sobre el diagnóstico y tratamiento de la IC aguda y crónica.
https://onlinejcf.com/article/S1071-9164(21)00208-6/fulltext
Tsutsui H, Ide T, Ito H, Kihara Y, Kinugawa K, Kinugawa S, et al; on behalf of the Japanese Circulation Society and the Japanese Heart Failure Society Joint Working Group. JCS/JHFS 2021 guideline focused update on diagnosis and treatment of acute and chronic heart failure. Circ J. 2021; 85: 2252-2291.
Recursos relacionados
- Consulta rápida: Tratamiento de la insuficiencia cardíaca con fracción de eyección reducida
- Consulta rápida: Manejo de la HTA en situaciones especiales II
- Consulta rápida: Convivir con HTA: la importancia de la sal
- Artículos científicos: Adherencia a la medicación en medicina cardiovascular
Recursos en línea y apps para médicos
Existen webs y aplicaciones para dispositivos móviles diseñadas para facilitar el abordaje de las enfermedades cardiovasculares por parte de los profesionales.
Webs de cardiología e insuficiencia cardíaca para médicos
Sociedad Española de Cardiología (SEC)
En su sitio web se pueden encontrar materiales relacionados con la especialidad de cardiología, incluyendo guías clínicas y material docente para los profesionales de la salud.
Una web muy completa dirigida a cardiólogos, internistas, médicos de familia y cualquier profesional médico interesado en la cardiología. Contiene guías clínicas (inluidas las guías europeas traducidas al español), infografías, libros electrónicos, vídeos, etc.
Apps de cardiología para médicos
ESC Pocket Guidelines
La aplicación contiene 24 guías clínicas elaboradas por la Sociedad Europea de Cardiología (ESC). Además, proporciona herramientas interactivas, como algoritmos, escalas, calculadoras, gráficos y similares.
Disponible para dispositivos Android y Apple.
Recursos para pacientes
Información para pacientes
Descargar en PDF los conejos para pacientes con insuficiencia cardíaca
Recursos en línea para pacientes
El consejo del médico puede completarse recomendando webs y apps que sirvan a los pacientes para mejorar la información que tienen sobre su enfermedad, así como para apoyarlos en el cambio de los hábitos de vida y en la correcta toma del tratamiento.
Recursos relacionados
- Sección: Webs y apps para pacientes
- Blog: ¿Cómo usar las redes sociales para comunicarte con los pacientes?
Webs de cardiología para pacientes
Vidas que laten es la página web del área de pacientes de Almirall.
Se trata de un espacio educacional dirigido a los pacientes con enfermedades cardiovasculares y a sus cuidadores. El objetivo es que entiendan en qué consiste su enfermedad y que puedan afrontarla con información veraz y fiable.
Los contenidos de la web han sido desarrollados por un grupo de especialistas en cardiología, rehabilitación cardíaca y ejercicio, y se dividen en dos grandes bloques:
- Enfermedad cardiovascular: en este apartado se ofrecen recursos y herramientas para que los pacientes tengan un papel activo en su enfermedad y puedan mejorar su evolución. Esta sección contiene información sobre las enfermedades cardiovasculares, aspectos psicológicos de las mismas o recomendaciones para seguir una dieta cardiosaludable.
- Ejercicio: en este bloque se proponen ejercicios adaptados a los pacientes con enfermedades cardiovasculares para que mejoren su capacidad funcional y aumenten su sensación de bienestar.
Vidas que laten es una web muy visual con contenidos esquemáticos y resumidos. Los pacientes tienen acceso a información de alta calidad científica pero explicada con un lenguaje comprensible y mostrada de forma atractiva y, sobre todo, muy práctica.
Fundación Española del Corazón
Sitio web de la Sociedad Española de Cardiología dedicado al paciente con patología cardiovascular. Cuenta con secciones dedicadas a los diferentes trastornos cardiovasculares (infarto de miocardio, fibrilación auricular, insuficiencia cardíaca, valvulopatías, arritmias, etc.).
Se trata de una iniciativa puesta en marcha hace algunos años por la Agencia Española de Seguridad Alimentaria (AESAN), dependiente del Ministerio de Sanidad, que tiene por objetivo controlar el consumo de sal y grasas. Es una web muy didáctica y visualmente atractiva que cuenta con toda una sección dedicada a conocer la sal. En ella encontramos información sobre El etiquetado de los productos; la sección Sal visible e invisible, que informa sobre los tipos de sal y qué alimentos la llevan; o los consejos sobre Cómo reducir el consumo de sal.
Página web creada por cardiólogos de reconocido prestigio y dedicada a la insuficiencia cardíaca (IC).
Bibliografía
- Reddy YNV, Borlaug BA. Heart Failure With Preserved Ejection Fraction. Curr Probl Cardiol [Internet]. 2016 [citado 5 de diciembre de 2023];41(4):145-88. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26952248/
- Sharma K, Kass DA. Heart failure with preserved ejection fraction: mechanisms, clinical features, and therapies. Circ Res [Internet]. 2014 [citado 5 de diciembre de 2023];115(1):79-96. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24951759/
- Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2022;79(17):e263-421.
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contributio. Vol. 75, Revista espanola de cardiologia (English ed.). Spain; 2022. p. 523.
- Colucci WS, Borlaug BA. Heart failure: Clinical manifestations and diagnosis in adults. UpToDate [Internet]. 2022;1-40. Disponible en: https://www-uptodate-com.ezproxy.csu.edu.au/contents/heart-failure-clinical-manifestations-and-diagnosis-in-adults?search=ejection fraction&topicRef=5331&source=see_link
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, Colvin MM, et al. 2017 ACC/AHA/HFSA Focused Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation [Internet]. 2017 [citado 5 de diciembre de 2023];136(6):e137-61. Disponible en: https://www.ahajournals.org/doi/abs/10.1161/CIR.0000000000000509
- Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure. J Card Fail. 2022;28(5):e1-167.
- Savarese G, Becher PM, Lund LH, Seferovic P, Rosano GMC, Coats AJS. Global burden of heart failure: a comprehensive and updated review of epidemiology. Cardiovasc Res [Internet]. 2023 [citado 19 de diciembre de 2023];118(17):3272-87. Disponible en: https://dx.doi.org/10.1093/cvr/cvac013
- Brouwers FP, De Boer RA, Van Der Harst P, Voors AA, Gansevoort RT, Bakker SJ, et al. Incidence and epidemiology of new onset heart failure with preserved vs. reduced ejection fraction in a community-based cohort: 11-year follow-up of PREVEND. Eur Heart J [Internet]. 2013 [citado 18 de diciembre de 2023];34(19):1424-31. Disponible en: https://pubmed.ncbi.nlm.nih.gov/23470495/
- Conrad N, Judge A, Tran J, Mohseni H, Hedgecott D, Crespillo AP, et al. Temporal trends and patterns in heart failure incidence: a population-based study of 4 million individuals. Lancet [Internet]. 2018 [citado 18 de diciembre de 2023];391(10120):572-80. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29174292/
- James SL, Abate D, Abate KH, Abay SM, Abbafati C, Abbasi N, et al. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet [Internet]. 2018 [citado 18 de diciembre de 2023];392(10159):1789-858. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30496104/
- Van Riet EES, Hoes AW, Limburg A, Landman MAJ, Van Der Hoeven H, Rutten FH. Prevalence of unrecognized heart failure in older persons with shortness of breath on exertion. Eur J Heart Fail [Internet]. 2014 [citado 18 de diciembre de 2023];16(7):772-7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24863953/
- Benjamin EJ, Virani SS, Callaway CW, Chamberlain AM, Chang AR, Cheng S, et al. Heart Disease and Stroke Statistics-2018 Update: A Report From the American Heart Association. Circulation [Internet]. 2018 [citado 18 de diciembre de 2023];137(12):E67-492. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29386200/
- Van Riet EES, Hoes AW, Wagenaar KP, Limburg A, Landman MAJ, Rutten FH. Epidemiology of heart failure: the prevalence of heart failure and ventricular dysfunction in older adults over time. A systematic review. Eur J Heart Fail [Internet]. 2016 [citado 18 de diciembre de 2023];18(3):242-52. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26727047/
- Maggioni AP, Dahlström U, Filippatos G, Chioncel O, Leiro MC, Drozdz J, et al. EURObservational Research Programme: Regional differences and 1-year follow-up results of the Heart Failure Pilot Survey (ESC-HF Pilot). Eur J Heart Fail [Internet]. 2013 [citado 18 de diciembre de 2023];15(7):808-17. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1093/eurjhf/hft050
- Maggioni AP, Dahlström U, Filippatos G, Chioncel O, Leiro MC, Drozdz J, et al. EURObservational Research Programme: regional differences and 1-year follow-up results of the Heart Failure Pilot Survey (ESC-HF Pilot). Eur J Heart Fail [Internet]. 2013 [citado 18 de diciembre de 2023];15(7):808-17. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1093/eurjhf/hft050
- Koh AS, Tay WT, Teng THK, Vedin O, Benson L, Dahlstrom U, et al. A comprehensive population-based characterization of heart failure with mid-range ejection fraction. Eur J Heart Fail [Internet]. 2017 [citado 18 de diciembre de 2023];19(12):1624-34. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28948683/
- Vadlamani L, Anderson K, Kumar S. USING TECHNOLOGY TO REDUCE READMISSION RATES FOR CONGESTIVE HEART FAILURE IN HIGH RISK PATIENTS. J Am Coll Cardiol. 2016;67(13):1410.
- Duca F, Zotter-Tufaro C, Kammerlander AA, Aschauer S, Binder C, Mascherbauer J, et al. Gender-related differences in heart failure with preserved ejection fraction. Scientific Reports 2018 8:1 [Internet]. 2018 [citado 19 de diciembre de 2023];8(1):1-9. Disponible en: https://www.nature.com/articles/s41598-018-19507-7
- Silverman MG, Patel B, Blankstein R, Lima JAC, Blumenthal RS, Nasir K, et al. Impact of Race, Ethnicity, and Multimodality Biomarkers on the Incidence of New-Onset Heart Failure with Preserved Ejection Fraction (from the Multi-Ethnic Study of Atherosclerosis). American Journal of Cardiology [Internet]. 2016 [citado 19 de diciembre de 2023];117(9):1474-81. Disponible en: http://www.ajconline.org/article/S0002914916302302/fulltext
- Doughty RN, Cubbon R, Ezekowitz J, Gonzalez-Juanatey J, Gorini M, Gotsman I, et al. The survival of patients with heart failure with preserved or reduced left ventricular ejection fraction: an individual patient data meta-analysis. Eur Heart J [Internet]. 2012 [citado 19 de diciembre de 2023];33(14):1750-7. Disponible en: https://dx.doi.org/10.1093/eurheartj/ehr254
- Rech M, Barandiarán Aizpurua A, Van Empel V, Van Bilsen M, Schroen B. Pathophysiological understanding of HFpEF: microRNAs as part of the puzzle. Cardiovasc Res [Internet]. 2018 [citado 29 de diciembre de 2023];114(6):782-93. Disponible en: https://dx.doi.org/10.1093/cvr/cvy049
- Van Empel V, Brunner-La Rocca HP. Inflammation in HFpEF: Key or circumstantial? Int J Cardiol [Internet]. 2015 [citado 29 de diciembre de 2023];189(1):259-63. Disponible en: http://www.internationaljournalofcardiology.com/article/S0167527315008335/fulltext
- Maruhashi T, Soga J, Fujimura N, Idei N, Mikami S, Iwamoto Y, et al. Endothelial function is impaired in patients receiving antihypertensive drug treatment regardless of blood pressure level FMD-J study (flow-mediated dilation Japan). Hypertension [Internet]. 2017 [citado 29 de diciembre de 2023];70(4):790-7. Disponible en: https://www.ahajournals.org/doi/abs/10.1161/HYPERTENSIONAHA.117.09612
- Mayet J, Hughes A. Cardiac and vascular pathophysiology in hypertension. Heart [Internet]. 2003 [citado 29 de diciembre de 2023];89(9):1104-9. Disponible en: https://heart.bmj.com/content/89/9/1104
- Lam CSP, Donal E, Kraigher-Krainer E, Vasan RS. Epidemiology and clinical course of heart failure with preserved ejection fraction. Eur J Heart Fail [Internet]. 2011 [citado 29 de diciembre de 2023];13(1):18-28. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1093/eurjhf/hfq121
- Nagueh SF, Smiseth OA, Appleton CP, Byrd BF, Dokainish H, Edvardsen T, et al. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging [Internet]. 2016 [citado 29 de diciembre de 2023];17(12):1321-60. Disponible en: https://dx.doi.org/10.1093/ehjci/jew082
- Adamczak DM, Oduah MT, Kiebalo T, Nartowicz S, Bęben M, Pochylski M, et al. Heart Failure with Preserved Ejection Fraction—a Concise Review [Internet]. Vol. 22, Current Cardiology Reports. Curr Cardiol Rep; 2020 [citado 3 de diciembre de 2023]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32648130/
- Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2022;79(17):1757-80.
- Lee DS, Gona P, Vasan RS, Larson MG, Benjamin EJ, Wang TJ, et al. Relation of disease pathogenesis and risk factors to heart failure with preserved or reduced ejection fraction: insights from the framingham heart study of the national heart, lung, and blood institute. Circulation [Internet]. 2009 [citado 27 de diciembre de 2023];119(24):3070-7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/19506115/
- Groenewegen A, Rutten FH, Mosterd A, Hoes AW. Epidemiology of heart failure. Eur J Heart Fail [Internet]. 2020 [citado 29 de diciembre de 2023];22(8):1342-56. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1002/ejhf.1858
- Chang PP, Wruck LM, Shahar E, Rossi JS, Loehr LR, Russell SD, et al. Trends in Hospitalizations and Survival of Acute Decompensated Heart Failure in Four US Communities (2005–2014). Circulation [Internet]. 2018 [citado 29 de diciembre de 2023];138(1):12-24. Disponible en: https://www.ahajournals.org/doi/abs/10.1161/CIRCULATIONAHA.117.027551
- Lee DS, Gona P, Vasan RS, Larson MG, Benjamin EJ, Wang TJ, et al. Relation of Disease Pathogenesis and Risk Factors to Heart Failure With Preserved or Reduced Ejection Fraction. Circulation [Internet]. 2009 [citado 29 de diciembre de 2023];119(24):3070-7. Disponible en: https://www.ahajournals.org/doi/abs/10.1161/CIRCULATIONAHA.108.815944
- Curl CL, Danes VR, Bell JR, Raaijmakers AJA, Ip WTK, Chandramouli C, et al. Cardiomyocyte functional etiology in heart failure with preserved ejection fraction is distinctive-a new preclinical model. J Am Heart Assoc [Internet]. 2018 [citado 29 de diciembre de 2023];7(11). Disponible en: https://www.ahajournals.org/doi/abs/10.1161/JAHA.117.007451
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, Drazner MH, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol [Internet]. 2013 [citado 27 de diciembre de 2023];62(16). Disponible en: https://pubmed.ncbi.nlm.nih.gov/23747642/
- He J, Ogden LG, Bazzano LA, Vupputuri S, Loria C, Whelton PK. Risk factors for congestive heart failure in US men and women: NHANES I epidemiologic follow-up study. Arch Intern Med [Internet]. 2001 [citado 27 de diciembre de 2023];161(7):996-1002. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11295963/
- Baldasseroni S, Opasich C, Gorini M, Lucci D, Marchionni N, Marini M, et al. Left bundle-branch block is associated with increased 1-year sudden and total mortality rate in 5517 outpatients with congestive heart failure: A report from the Italian Network on Congestive Heart Failure. Am Heart J [Internet]. 2002 [citado 27 de diciembre de 2023];143(3):398-405. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11868043/
- He J, Ogden LG, Bazzano LA, Vupputuri S, Loria C, Whelton PK. Risk factors for congestive heart failure in US men and women: NHANES I epidemiologic follow-up study. Arch Intern Med [Internet]. 2001 [citado 5 de enero de 2024];161(7):996-1002. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11295963/
- Murphy SP, Ibrahim NE, Januzzi JL. Heart Failure with Reduced Ejection Fraction: A Review [Internet]. Vol. 324, JAMA – Journal of the American Medical Association. JAMA; 2020 [citado 3 de diciembre de 2023]. p. 488-504. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32749493/
- Formiga F, Nuñez J, Castillo Moraga MJ, Cobo Marcos M, Egocheaga MI, García-Prieto CF, et al. Diagnosis of heart failure with preserved ejection fraction: a systematic narrative review of the evidence [Internet]. Heart Failure Reviews. Heart Fail Rev; 2023 [citado 3 de diciembre de 2023]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/37861854/
- Russell SD, Saval MA, Robbins JL, Ellestad MH, Gottlieb SS, Handberg EM, et al. New York Heart Association functional class predicts exercise parameters in the current era. Am Heart J [Internet]. 2009 [citado 30 de diciembre de 2023];158(4 Suppl):S24. Disponible en: /pmc/articles/PMC2762947/
- Thibodeau JT, Turer AT, Gualano SK, Ayers CR, Velez-Martinez M, Mishkin JD, et al. Characterization of a Novel Symptom of Advanced Heart Failure: Bendopnea. JACC Heart Fail. 2014;2(1):24-31.
- Thibodeau JT, Turer AT, Gualano SK, Ayers CR, Velez-Martinez M, Mishkin JD, et al. Characterization of a Novel Symptom of Advanced Heart Failure: Bendopnea. JACC Heart Fail. 2014;2(1):24-31.
- Redfield MM, Borlaug BA. Heart Failure With Preserved Ejection Fraction: A Review [Internet]. Vol. 329, JAMA. American Medical Association; 2023 [citado 3 de diciembre de 2023]. p. 827-38. Disponible en: https://jamanetwork.com/journals/jama/fullarticle/2802310
- Anker SD, Sharma R. The syndrome of cardiac cachexia. Int J Cardiol [Internet]. 2002 [citado 30 de diciembre de 2023];85(1):51-66. Disponible en: https://pubmed.ncbi.nlm.nih.gov/12163209/
- Klapholz M, Maurer M, Lowe AM, Messineo F, Meisner JS, Mitchell J, et al. Hospitalization for heart failure in the presence of a normal left ventricular ejection fraction: Results of the New York heart failure registry. J Am Coll Cardiol. 2004;43(8):1432-8.
- Rashid AM, Khan MS, Fudim M, DeWald TA, DeVore A, Butler J. Management of Heart Failure With Reduced Ejection Fraction [Internet]. Vol. 48, Current Problems in Cardiology. Curr Probl Cardiol; 2023 [citado 3 de diciembre de 2023]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/36681212/
- McMurray J, Östergren J, Pfeffer M, Swedberg K, Granger C, Yusuf S, et al. Clinical features and contemporary management of patients with low and preserved ejection fraction heart failure: baseline characteristics of patients in the Candesartan in Heart failure-Assessment of Reduction in Mortality and morbidity (CHARM) programme. Eur J Heart Fail [Internet]. 2003 [citado 1 de enero de 2024];5(3):261-70. Disponible en: https://pubmed.ncbi.nlm.nih.gov/12798823/
- Davie AP, Francis CM, Caruana L, Sutherland GR, McMurray JJV. Assessing diagnosis in heart failure: which features are any use? QJM [Internet]. 1997 [citado 1 de enero de 2024];90(5):335-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/9205668/
- Kelder JC, Cramer MJ, Van Wijngaarden J, Van Tooren R, Mosterd A, Moons KGM, et al. The diagnostic value of physical examination and additional testing in primary care patients with suspected heart failure. Circulation [Internet]. 2011 [citado 1 de enero de 2024];124(25):2865-73. Disponible en: https://pubmed.ncbi.nlm.nih.gov/22104551/
- Sharma K, Kass DA. Heart failure with preserved ejection fraction: mechanisms, clinical features, and therapies. Circ Res [Internet]. 2014 [citado 1 de enero de 2024];115(1):79-96. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24951759/
- Davie AP, Francis CM, Love MP, Caruana L, Starkey IR, Shaw TRD, et al. Value of the electrocardiogram in identifying heart failure due to left ventricular systolic dysfunction. BMJ [Internet]. 1996 [citado 1 de enero de 2024];312(7025):222. Disponible en: https://pubmed.ncbi.nlm.nih.gov/8563589/
- Bjerkén LV, Rønborg SN, Jensen MT, Ørting SN, Nielsen OW. Artificial intelligence enabled ECG screening for left ventricular systolic dysfunction: a systematic review. Heart Fail Rev [Internet]. 2023 [citado 1 de enero de 2024];28(2):419-30. Disponible en: https://pubmed.ncbi.nlm.nih.gov/36344908/
- Mueller-Lenke N, Rudez J, Staub D, Laule-Kilian K, Klima T, Perruchoud AP, et al. Use of chest radiography in the emergency diagnosis of acute congestive heart failure. Heart [Internet]. 2006 [citado 1 de enero de 2024];92(5):695-6. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16159971/
- Davie AP, Francis CM, Caruana L, Sutherland GR, McMurray JJV. Assessing diagnosis in heart failure: which features are any use? QJM [Internet]. 1997 [citado 1 de enero de 2024];90(5):335-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/9205668/
- Davie AP, Francis CM, Caruana L, Sutherland GR, McMurray JJV. Assessing diagnosis in heart failure: which features are any use? QJM [Internet]. 1997 [citado 1 de enero de 2024];90(5):335-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/9205668/
- Mitter SS, Shah SJ, Thomas JD. A Test in Context: E/A and E/e’ to Assess Diastolic Dysfunction and LV Filling Pressure. J Am Coll Cardiol [Internet]. 2017 [citado 1 de enero de 2024];69(11):1451-64. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28302294/
- Obokata M, Reddy YNV, Melenovsky V, Sorimachi H, Jarolim P, Borlaug BA. Uncoupling between intravascular and distending pressures leads to underestimation of circulatory congestion in obesity. Eur J Heart Fail [Internet]. 2022 [citado 2 de enero de 2024];24(2):353-61. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1002/ejhf.2377
- Mueller C, McDonald K, de Boer RA, Maisel A, Cleland JGF, Kozhuharov N, et al. Heart Failure Association of the European Society of Cardiology practical guidance on the use of natriuretic peptide concentrations. Eur J Heart Fail [Internet]. 2019 [citado 2 de enero de 2024];21(6):715-31. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31222929/
- Madamanchi C, Alhosaini H, Sumida A, Runge MS. Obesity and natriuretic peptides, BNP and NT-proBNP: mechanisms and diagnostic implications for heart failure. Int J Cardiol [Internet]. 2014 [citado 2 de enero de 2024];176(3):611-7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25156856/
- Wei T, Zeng C, Chen L, Chen Q, Zhao R, Lu G, et al. Systolic and diastolic heart failure are associated with different plasma levels of B-type natriuretic peptide. Int J Clin Pract [Internet]. 2005 [citado 2 de enero de 2024];59(8):891-4. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16033608/
- Maggioni AP, Dahlström U, Filippatos G, Chioncel O, Leiro MC, Drozdz J, et al. EURObservational Research Programme: regional differences and 1-year follow-up results of the Heart Failure Pilot Survey (ESC-HF Pilot). Eur J Heart Fail [Internet]. 2013 [citado 2 de enero de 2024];15(7):808-17. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1093/eurjhf/hft050
- Hassan OKA, Higgins AR. The role of multimodality imaging in patients with heart failure with reduced and preserved ejection fraction. Curr Opin Cardiol [Internet]. 2022 [citado 2 de enero de 2024];37(3):285-93. Disponible en: https://pubmed.ncbi.nlm.nih.gov/35612940/
- Anderson T, Hummel SL, Konerman MC. Epidemiology, Diagnosis, Pathophysiology, and Initial Approach to Heart Failure with Preserved Ejection Fraction. Cardiol Clin [Internet]. 2022 [citado 2 de enero de 2024];40(4):397-413. Disponible en: https://pubmed.ncbi.nlm.nih.gov/36210127/
- Minasian AG, van den Elshout FJJ, Dekhuijzen PNR, Vos PJE, Willems FF, van den Bergh PJPC, et al. COPD in chronic heart failure: less common than previously thought? Heart Lung [Internet]. 2013 [citado 2 de enero de 2024];42(5):365-71. Disponible en: https://pubmed.ncbi.nlm.nih.gov/23998385/
- Forsyth F, Brimicombe J, Cheriyan J, Edwards D, Hobbs FDR, Jalaludeen N, et al. Characteristics of patients with heart failure with preserved ejection fraction in primary care: a cross-sectional analysis. BJGP Open [Internet]. 2021 [citado 2 de enero de 2024];5(6). Disponible en: https://bjgpopen.org/content/5/6/BJGPO.2021.0094
- Hsu JJ, Ziaeian B, Fonarow GC. Heart Failure With Mid-Range (Borderline) Ejection Fraction: Clinical Implications and Future Directions. JACC Heart Fail [Internet]. 2017 [citado 4 de enero de 2024];5(11):763-71. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29032140/
- Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2022;79(17):e263-421.
- McDonald M, Virani S, Chan M, Ducharme A, Ezekowitz JA, Giannetti N, et al. CCS/CHFS Heart Failure Guidelines Update: Defining a New Pharmacologic Standard of Care for Heart Failure With Reduced Ejection Fraction. Can J Cardiol. 2021;37(4):531-46.
- Fudim M, Abraham WT, von Bardeleben RS, Lindenfeld JA, Ponikowski PP, Salah HM, et al. Device Therapy in Chronic Heart Failure: JACC State-of-the-Art Review. J Am Coll Cardiol. 2021;78(9):931-56.
- Egbuche O, Hanna B, Onuorah I, Uko E, Taha Y, Ghali JK, et al. Contemporary Pharmacologic Management of Heart Failure with Reduced Ejection Fraction: A Review. Curr Cardiol Rev [Internet]. 2019 [citado 3 de diciembre de 2023];16(1):55-64. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31288726/
- Pardo-Martínez P, Barge-Caballero E, Bouzas-Mosquera A, Barge-Caballero G, Couto-Mallón D, Paniagua-Martín MJ, et al. Real world comparison of spironolactone and eplerenone in patients with heart failure. Eur J Intern Med [Internet]. 2022 [citado 9 de febrero de 2024];97:86-94. Disponible en: https://pubmed.ncbi.nlm.nih.gov/35000806/
- Swedberg K, Komajda M, Böhm M, Borer J, Robertson M, Tavazzi L, et al. Effects on outcomes of heart rate reduction by ivabradine in patients with congestive heart failure: is there an influence of beta-blocker dose?: findings from the SHIFT (Systolic Heart failure treatment with the I(f) inhibitor ivabradine Trial) study. J Am Coll Cardiol [Internet]. 2012 [citado 4 de enero de 2024];59(22):1938-45. Disponible en: https://pubmed.ncbi.nlm.nih.gov/22617188/
- Swedberg K, Komajda M, Böhm M, Borer JS, Ford I, Dubost-Brama A, et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet [Internet]. 2010 [citado 4 de enero de 2024];376(9744):875-85. Disponible en: https://pubmed.ncbi.nlm.nih.gov/20801500/
- Taylor RS, Walker S, Smart NA, Piepoli MF, Warren FC, Ciani O, et al. Impact of exercise-based cardiac rehabilitation in patients with heart failure (ExTraMATCH II) on mortality and hospitalisation: an individual patient data meta-analysis of randomised trials. Eur J Heart Fail [Internet]. 2018 [citado 4 de enero de 2024];20(12):1735-43. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30255969/
- Doughty RN, Cubbon R, Ezekowitz J, Gonzalez-Juanatey J, Gorini M, Gotsman I, et al. The survival of patients with heart failure with preserved or reduced left ventricular ejection fraction: an individual patient data meta-analysis. Eur Heart J [Internet]. 2012 [citado 25 de enero de 2024];33(14):1750-7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/21821849/
- Henning RJ. Diagnosis and treatment of heart failure with preserved left ventricular ejection fraction. World J Cardiol [Internet]. 2020 [citado 4 de enero de 2024];12(1):7-25. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31984124/
- Dunlay SM, Roger VL, Redfield MM. Epidemiology of heart failure with preserved ejection fraction. Nature Reviews Cardiology 2017 14:10 [Internet]. 2017 [citado 4 de enero de 2024];14(10):591-602. Disponible en: https://www.nature.com/articles/nrcardio.2017.65
- Crespo-Leiro MG, Metra M, Lund LH, Milicic D, Costanzo MR, Filippatos G, et al. Advanced heart failure: a position statement of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail [Internet]. 2018 [citado 4 de enero de 2024];20(11):1505-35. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29806100/
- Simpson J, Jhund PS, Lund LH, Padmanabhan S, Claggett BL, Shen L, et al. Prognostic Models Derived in PARADIGM-HF and Validated in ATMOSPHERE and the Swedish Heart Failure Registry to Predict Mortality and Morbidity in Chronic Heart Failure. JAMA Cardiol [Internet]. 2020 [citado 4 de enero de 2024];5(4):432-41. Disponible en: https://jamanetwork.com/journals/jamacardiology/fullarticle/2759798
ES-EPR-2400002